题目内容
7.已知岩层中的铁橄榄石Fe2SiO4会缓慢转化为磁铁矿:3Fe2SiO4+2CO2→2Fe3O4+3SiO2+2CO,下列说法正确的是( )| A. | 氧化产物为Fe3O4和SiO2 | |
| B. | 氧化剂与还原剂物质的量的之比为2:3 | |
| C. | 当有1.5mol Fe2SiO4参加反应时,转移的电子为3 mol | |
| D. | 当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol |
分析 3Fe2SiO4+2CO2→2Fe3O4+3SiO2+2CO反应中,C元素的化合价降低,Fe元素的化合价升高,Si元素的化合价不变,据此分析.
解答 解:A、反应中Fe元素的化合价升高,Si元素的化合价不变,则氧化产物为Fe3O4,故A错误;
B、反应中CO2为氧化剂,Fe2SiO4为还原剂,3mol还原剂中只有$\frac{2}{3}$被氧化,则氧化剂与还原剂物质的量的之比为1:1,故B错误;
C、当有3mol Fe2SiO4参加反应时,转移的电子为4 mol,则有1.5mol Fe2SiO4参加反应时,转移的电子为2 mol,故C错误;
D、1molFe2SiO4失去2mol电子,1mol CO2得到2mol电子,所以当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol,故D正确.
故选D.
点评 本题考查了氧化还原反应,题目难度不大,注意根据化合价的变化分析解答,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
17.某混合气体由两种气态烃组成,取2.24L该混合气体完全燃烧后得到4.48L二氧化碳(气体体积都已折算为标准状况)和3.6g水,则这两种气体可能是( )
| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C3H4 | D. | C2H4和C2H6 |
18.下列关于价电子构型3s23p4的描述不正确的是( )
| A. | 它的元素符号为S | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 可以与H2化合生成气态化合物 | |
| D. | 其轨道表示式为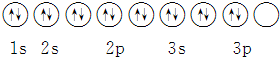 |
15.有一种苯的同系物,分子式为C9H12,苯环上只含有一个取代基,则其与氢气完全加成后的产物的一氯代物有(不考虑立体异构)( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
2.下列区别苯和己烯的实验方法不正确的是( )
| A. | 分别点燃,有黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,上、下两层红棕色均消失的是己烯 | |
| C. | 分别加入溴水振荡,静置后分层,下层红棕色消失的是己烯 | |
| D. | 分别加入酸性高锰酸钾溶液,振荡,静置后水层紫色消失的是己烯 |
6.室温下下列各组离子或分子在指定的溶液中一定能大量共存的是( )
| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
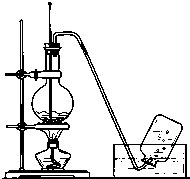 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时: