题目内容
17.某混合气体由两种气态烃组成,取2.24L该混合气体完全燃烧后得到4.48L二氧化碳(气体体积都已折算为标准状况)和3.6g水,则这两种气体可能是( )| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C3H4 | D. | C2H4和C2H6 |
分析 2.24L该混合气体的物质的量为0.1mol,完全燃烧得到4.48L二氧化碳和3.6g水,生成二氧化碳的物质的量为0.2mol,水的物质的量为0.2mol,则混合气体平均分子式为C2H4,据此对各选项进行判断.
解答 解:n(混合烃)=n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol、n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
即0.1mol该混合气体中含有0.2molC原子、0.4molH原子,
所以该烃的平均分子式为C2H4,
①C原子数小于2的烃只有甲烷,所以另一种烃碳个数大于2且氢原子数等于4,可以是CH4、C3H4的混合物,
②若碳个数均为2,则两种烃分子中氢原子个数一个大于4,另一个小于4,
A.CH4和C3H8混合,平均H原子数目介于4~8之间,不可能为4,故A错误;
B.CH4和C3H4按照1:1混合,平均分子式为C2H4,故B正确;
C.C2H4和C3H4混合,平均C原子数目介于2~3之间,不可能为2,故C错误;
D.C2H4和C2H6混合,以任意比混合,平均C原子数目都是2,平均H原子数目介于4~6之间,不可能为4,故D错误;
故选B.
点评 本题考查混合物的计算、有机物分子式的确定,题目难度中等,关键是利用平均分子组成判断烃的组成,注意掌握质量守恒定律在确定有机物分子式中的应用.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
7.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的用量 | B. | 增大反应体系的压强使体积改变 | ||
| C. | 升高体系的反应温度 | D. | 将容器的体积缩小一半 |
8. 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
①c1合理的数值为D(填字母) A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
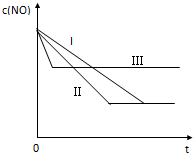
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
则曲线I、Ⅱ、Ⅲ对应的实验编号依次为③②①
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol•L-1 | 10.0 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)10-3mol•L-1 | 3.60 | c2 | 2.75 | 2.70 | 2.70 |
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
| 实验 序号 | T/℃ | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比表面积/㎡•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
12.下列实验方案合理的是( )
| A. | 鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 | |
| B. | 检验酒精中的少量水:向酒精中加入足量生石灰 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如右图所示的实验装置 |
9.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
6.某学生做乙醛的还原性实验时,取1mol/LCuSO4溶液和0.5mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,结果无红色沉淀出现.导致该实验失败的原因可能是( )
| A. | 充分加热至沸腾 | B. | 加入乙醛太少 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
7.已知岩层中的铁橄榄石Fe2SiO4会缓慢转化为磁铁矿:3Fe2SiO4+2CO2→2Fe3O4+3SiO2+2CO,下列说法正确的是( )
| A. | 氧化产物为Fe3O4和SiO2 | |
| B. | 氧化剂与还原剂物质的量的之比为2:3 | |
| C. | 当有1.5mol Fe2SiO4参加反应时,转移的电子为3 mol | |
| D. | 当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol |