��Ŀ����
5��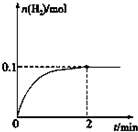 ��-��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��-��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ����SO2+2H2O+I2�TH2SO4+2HI[��C
��2HI?H2+I2
��2H2SO4�T2SO2+O2+2H2O
��1������������Ӧ�������ж���ȷ����c
a����ӦIII���ڳ����½��С���������������
b����ӦI��SO2�����Ա�HIǿ
c��ѭ���������貹��H2O������������������
d��ѭ�������в���1molO2��ͬʱ����1molH2
��2��һ���¶��£���1L�ܱ������м���1molHI��g����������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
0-2min�ڵ�ƽ����Ӧ����v��HI��=0.1mol/��L•min����
��3�����й��ڻ�ѧ��Ӧ���ʵ�˵����ȷ����D��
A�����κλ�ѧ��Ӧ��˵����Ӧ����Խ��Ӧ�����Խ����
B����ѧ��Ӧ���ʳ��õ�λʱ�����κ�һ�ַ�Ӧ�����ʵ����ļ�С�����������ʵ�������������ʾ
C�����淴Ӧ�ﵽ��ѧƽ��״̬ʱ�������淴Ӧ�����ʶ�Ϊ0
D������Ӧ���Ũ�ȡ���߷�Ӧ�¶ȶ�������Ӧ����
��4����һ�������¡�1L���ܱ������У���˵����Ӧ��ﵽ��ѧƽ��״̬����A��
A������������ɫ���ٱ仯
B�����������ܶȲ��ٸı�
C����Ӧ������и�������ʵ�Ũ�����
D��H2��HI��I2�������ʵķ�Ӧ����֮��Ϊ1��2��1
E������������ѹǿ���䣮
���� ��1��a�����᳣���£����ֽ⣻
b����Ӧ�ж���������ֻ�ԭ�ԣ������Ա�HIǿ��
c��1molSO2����2molH2O����1molH2SO4��1molH2SO4�ֽ�����1molSO2��1molH2O��
d���ɢ��֪����lmolO2��ͬʱ����2molSO2����I��֪2molSO2����4molHI���ɢ��֪4molHI�ֽ�����2mol H2��
��2����ͼ��֪��2min��H2���ʵ����ı仯����Ȼ����㻯ѧ��Ӧ���ʣ������û�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�������
��3��A����Ӧ�����뷴Ӧ����û��ֱ�ӹ�ϵ��B����ѧ��Ӧ�������õ�λʱ����Ũ�ȵı仯������ʾ�ģ�
C����ѧƽ��Ϊ��̬ƽ�⣻
D������Ũ�ȡ������¶ȵ���ʹ��Ӧ���ʼӿ죻
��4�����淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ������ȣ�����ֵ�Ũ�Ȳ��ٱ仯���÷�Ӧ���ص�Ϊ��һ�ǿ��淴Ӧ�����Ƿ�Ӧǰ�������������ȣ���������ѹǿ֮�ȵ����������ʵ���֮���ƶϣ��÷�Ӧ��������Ӧ��������ѹǿ�Dz��仯�ģ�
��� �⣺��1��a�����᳣�����¶ȣ����ֽ⣬��a����
b����Ӧ�ж���������ֻ�ԭ�ԣ���ԭ�Ա�HIǿ���ⵥ�������Դ��ڶ�������b����
c��1molSO2����2molH2O����1molH2SO4��1molH2SO4�ֽ�����1molSO2��1molH2O��ѭ����ˮ�������٣���Ӧ����ˮ����c��ȷ��
d���ɢ��֪����lmolO2��ͬʱ����2molSO2����I��֪2molSO2����4molHI���ɢ��֪4molHI�ֽ�����2mol H2����ѭ�������в���l mol O2��ͬʱ����2mol H2����d����
�ʴ�Ϊ��c��
��2����ͼ��֪2min�����������ʵ���������0.1mol����������Ũ��Ϊ$\frac{0.1mol}{1L}$=0.1mol/L����������ʾ�Ļ�ѧ��Ӧ����Ϊ$\frac{0.1mol/L}{2min}$=0.05mol/��L��min����
�ɷ�Ӧ�еĻ�ѧ��������֪v��HI��=0.05mol/��L��min����2=0.1mol/��L��min����
�ʴ�Ϊ��0.1mol/��L��min����
��3��A����Ӧ���ʿ������һ�����ԣ���NaOH��HCl�ķ�Ӧ����Ӧ������������������ԣ��������⣬��A����B����ѧ��Ӧ���ʳ��õ�λʱ�����κ�һ�ַ�Ӧ�����ʵ���Ũ�ȵļ�С�����������ʵ���Ũ�ȵ���������ʾ����B����
C����ѧƽ��Ϊ��̬ƽ�⣬��ƽ��״̬�����淴Ӧ������ȣ�����Ϊ0����C����
D������Ũ��ʹ�������Ŀ���ࡢ�����¶�ʹ����Ӱٷ�����������ʹ��Ӧ���ʼӿ죬��D��ȷ��
�ʴ�Ϊ��D��
��4����Ӧ��Ϊ2HI?H2+I2
A������������ɫ���ٱ仯��˵������Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬����A��ȷ��
B����Ӧǰ������������������䣬���������ܶ�ʼ�ղ��ı䣬����˵����Ӧ�ﵽƽ��״̬����B����
C������Ũ�Ⱥ���ʼ�����仯���йأ���Ӧ������и�������ʵ�Ũ����Ȳ���˵����Ӧ�ﵽƽ��״̬����C����
D��H2��HI��I2�������ʵķ�Ӧ����֮��Ϊ1��2��1��ֻ��˵���÷�Ӧ������Ӧ����֮�ȣ�������˵�����淴Ӧ������ͬ����D����
E����Ӧǰ������������䣬ѹǿʼ�ղ��䣬����������ѹǿ���䲻��˵����Ӧ�ﵽƽ��״̬����E����
�ʴ�Ϊ��A��
���� ������Ҫ�����˷�Ӧ����ʽ�ķ��������㣬��Ӧƽ��ͼ��ѧƽ���־����ѧƽ��ͷ�Ӧ����Ӱ�����صķ���Ӧ�ã��Ѷ��еȣ�����ͼ��Ҫ����ͼ��ĺ��塢�յ㡢ƽ��㣬���ƽ���ƶ����ɽ����жϣ�

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�| A�� | 12.5g | B�� | 13.2g | C�� | 19.7g | D�� | 24.4g |
| A�� | �÷�Ӧ������ӦΪ���ȷ�Ӧ | |
| B�� | ���º����£�����ѹǿ��H2Ũ��һ����С | |
| C�� | �����¶ȣ��淴Ӧ���ʼ�С | |
| D�� | ��Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ��CO��g��+H2O��g��$\frac{\underline{\;\;����\;\;}}{���¸�ѹ}$CO2��g��+H2��g����H��0 kJ/mol |

| ѡ�� | ʵ������ | ���� |
| A | ���ձ��������������ݣ��ұ��ձ���ͭ���������� | ��ԣ�Al��Fe��Cu |
| B | �������Ϊ��ɫ���ұ�����Ϊ��ɫ | ��ԭ�ԣ�I-��Br+��Cl- |
| C | ��ʼͭ�۲��ܽ⣬��Һ����ɫ����������ų�����Һ����ɫ | �����ԣ�NaNO3��H2SO4��Cu2+ |
| D | ��ƿ��������������ձ���Һ������ | �ǽ����ԣ�Cl��C��Si |
| A�� | A | B�� | B | C�� | C | D�� | D |
 ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ���ⶨ�����Ũ����ʵ�����н���ʵ�飮�����������գ�
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ���ⶨ�����Ũ����ʵ�����н���ʵ�飮�����������գ���1������100ml 0.10mol•L-1NaOH����Һ�����������0.4g�������ƹ��壮
��2��ȡ20.00mL����������Һ������ƿ�У����μ�2��3�η�̪��ָʾ�������Լ����Ƶı�ҺNaOH��Һ���еζ����ظ������ζ�����2��3�Σ���¼�������£�
| ʵ���� | NaOH��Һ��Ũ�� | �ζ����ʱ��NaOH��Һ��������/mL | ������������/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
�ڸ����������ݣ��ɼ�����������Ũ��ԼΪ0.11mol/L��������λ��Ч���֣���
����ȥ��ʽ�ζ��������ݵķ���Ӧ������ͼ��ʾ�����еı���Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��
��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ��У�DF��
A���ζ��յ����ʱ���Ӷ���
B����ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������Һ��ϴ
C����ƿˮϴ��δ����
D������NaOH�������Na2CO3����
E�����ƺõ�NaOH����Һ���治��������������е�CO2��Ӧ������Na2CO3
F����ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ��
| A�� | pH=1����Һ�У�Na+��Cl-��K+��HS- | |
| B�� | ˮ�������c��H+��=10-12mol/L�У�Ba2+��K+��Cl-��CO32- | |
| C�� | $\frac{c��O{H}^{-}��}{c��{H}^{+}��}$=1012��ˮ��Һ�У�CH3COO-��CO32-��Na+��K+ | |
| D�� | c��Al3+��=1mol/L����Һ�У�Na+��NO3-��SO42-��HCO3- |
| A�� | ��ѧ��Ӧ���ʹ�ϵ�ǣ�3�ԣ�NH3���T2�ԣ�H2O�� | |
| B�� | ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬ | |
| C�� | �ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ��٣��淴Ӧ�������� | |
| D�� | �ﵽ��ѧƽ��ʱ��5������O2��=4������NO�� |
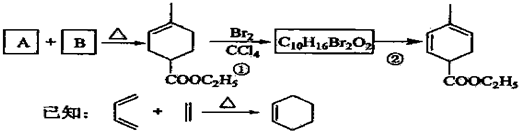
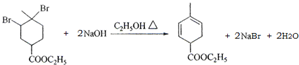 ��
��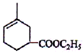 ��
��