题目内容
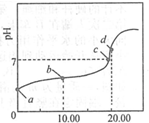
19.常温下,向10mL0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a、b、c三点的pH为实验所测得.下列有关说法中一定错误的是( )
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
分析 A.氯化氢为强电解质,在溶液中完全电离出氢离子;
B.一水合氨为弱电解质,当氨水体积为10mL时,二者恰好反应生成氯化铵,溶液显示酸性,若为中性,则氨水应该稍过量;
C.当7<pH<9时,溶液显示碱性,则c(H+)<c(OH-),结合电荷守恒可知:c(NH4+)>c(Cl-);
D.一水合氨为弱碱,0.1mol/L的氨水中氢氧根离子浓度小于0.1mol/L.
解答 解:A.常温下,0.1mol•L-1的HCl溶液中氢离子浓度为0.1mol/L,则溶液的pH=1,故A正确;
B.当两溶液恰好反应时生成强酸弱碱盐氯化铵,溶液呈酸性,若满足溶液的pH=7,所加NH3•H2O溶液的体积应该大于10mL,故B正确;
C.当7<pH<9时,溶液呈碱性,则c(H+)<c(OH-),根据溶液中的电荷守恒可知:c(NH4+)>c(Cl-),故C正确;
D.0.1mol•L-1的NH3•H2O溶液中氢氧根离子浓度一定小于0.1mol/L,溶液的pH小于13,则混合液的pH一定小于13,故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
9. 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )| A. | a点PH=2 | |
| B. | b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) | |
| C. | c点表示NaOH溶液与CH3COOH溶液恰好完全反应 | |
| D. | d点对用的溶液中,水的电离程度小于同温下纯水的电离程度 |
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
7.已知短周期元素形成的离子aA+、bB2+、cC-、dD2-均具有相同的电子层结构,下列判断正确的是( )
| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
14.常温下,下列各组离子一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Cl-、K+、HS- | |
| B. | 水电离出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的水溶液中:CH3COO-、CO32-、Na+、K+ | |
| D. | c(Al3+)=1mol/L的溶液中:Na+、NO3-、SO42-、HCO3- |
4.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
8.25时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表:下列判断不正确的是( )
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(H2A) | c(NaOH) | ||
| ① | X | 0.10 | 9 |
| ② | 0.10 | 0.10 | 5 |
| A. | X<0.1 | |
| B. | HA-的电离程度大于水解程度 | |
| C. | 将实验①所得溶液加水稀释后,$\frac{c({A}^{2-})}{c(H{A}^{-})}$变大 | |
| D. | 实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
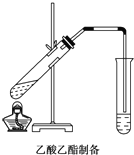 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验. ;用电子式表示D元素和G元素形成化合物的过程:
;用电子式表示D元素和G元素形成化合物的过程: .
.