题目内容
18.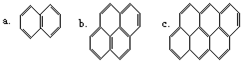 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )| A. | 100% | B. | 56% | C. | 97.3% | D. | 93.8% |
分析 从A、B、C的结构简式可知,其分子式分别为C10H8、C16H10、C22H12,从分子式可知,每增加两个苯环,分子中就增加6个碳原子,增加2个氢原子,故该系列化合物的通式为C6n+4H2n+6,根据通式计算.
解答 解:从A、B、C的结构简式可知,其分子式分别为C10H8、C16H10、C22H12,从分子式可知,每增加两个苯环,分子中就增加6个碳原子,增加2个氢原子,故该系列化合物的通式为C6n+4H2n+6,
ω(C)=$\frac{12(6n+4)}{12(6n+4)+2n+6}$×100%=$\frac{36n+24}{37n+27}$×100%=$\frac{36+\frac{24}{n}}{37+\frac{27}{n}}$×100%,当n→+∞时,ω(C)的最大值为$\frac{36}{37}$×100%=97.3%,
故选:C.
点评 本题考查了有机物中碳的质量分数的计算,题目难度中等,注意根据结构简式写出通式再计算质量分数,考查了学生的分析能力和计算能力.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
1.如图为Zn、铜水果电池装置示意图,下列说法正确的是( )
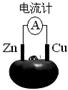

| A. | 铜片为负极,发生还原反应 | B. | 锌片上发生还原反应:Zn-2e-=Zn2+ | ||
| C. | 该装置将电能转变为化学能 | D. | 电子由锌片沿导线流向铜极 |
9.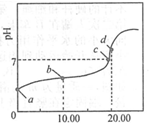 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )| A. | a点PH=2 | |
| B. | b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) | |
| C. | c点表示NaOH溶液与CH3COOH溶液恰好完全反应 | |
| D. | d点对用的溶液中,水的电离程度小于同温下纯水的电离程度 |
13.根据现象分析,所得结论正确的是( )


| 选项 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 还原性:I->Br+>Cl- |
| C | 开始铜粉不溶解,溶液呈无色,后有气体放出,溶液呈蓝色 | 氧化性:NaNO3>H2SO4>Cu2+ |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
3.将H2S和SO2气体分别通入下列溶液中,只有一种气体反应是( )
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
7.已知短周期元素形成的离子aA+、bB2+、cC-、dD2-均具有相同的电子层结构,下列判断正确的是( )
| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
8.25时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表:下列判断不正确的是( )
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(H2A) | c(NaOH) | ||
| ① | X | 0.10 | 9 |
| ② | 0.10 | 0.10 | 5 |
| A. | X<0.1 | |
| B. | HA-的电离程度大于水解程度 | |
| C. | 将实验①所得溶液加水稀释后,$\frac{c({A}^{2-})}{c(H{A}^{-})}$变大 | |
| D. | 实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
 .
.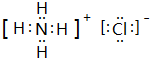 ,A2C2的电子式为
,A2C2的电子式为 .
.