题目内容
2.下列关于元素周期律和元素周期表的说法中正确的是( )| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |
分析 A.元素周期表没有填满,还可以再发现新的元素;
B.原子最外层电子数决定元素的性质;
C.俄国化学家门捷列夫对元素周期表做出了巨大贡献;
D.有的元素单质有同素异形体.
解答 解:A.随着科学技术的发展,人们可以不断合成一些元素,元素周期表中元素的种类在不断的增加,故A错误;
B.原子最外层电子数决定元素的性质,元素周期表中元素的核外电子排布呈周期性变化,则元素性质呈周期性变化,故B正确;
C.俄国化学家门捷列夫对元素周期表做出了巨大贡献,而不是道尔顿,故C错误;
D.有的元素单质有同素异形体,如C有金刚石、石墨、足球烯等同素异形体,故D错误;
故选B.
点评 本题考查了元素周期表,涉及元素的性质、元素在周期表中的位置、基本概念等知识点,根据元素周期表的用途、物质的性质、基本概念等知识点来分析解答,题目难度不大.

练习册系列答案
相关题目
5.下列实验设计正确且能达到目的是( )
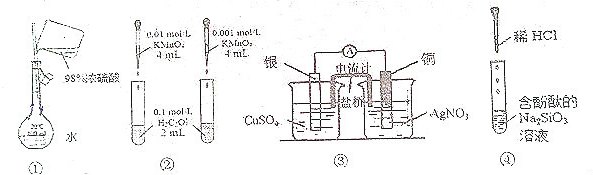

| A. | 装置①配制一定的物质的量浓度的稀硫酸溶液 | |
| B. | 装置②根据溶液褪色的快慢比较浓度对反应速率的影响 | |
| C. | 装置③制作原电池 | |
| D. | 装置④制备硅胶 |
13.根据现象分析,所得结论正确的是( )


| 选项 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 还原性:I->Br+>Cl- |
| C | 开始铜粉不溶解,溶液呈无色,后有气体放出,溶液呈蓝色 | 氧化性:NaNO3>H2SO4>Cu2+ |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
7.已知短周期元素形成的离子aA+、bB2+、cC-、dD2-均具有相同的电子层结构,下列判断正确的是( )
| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
14.常温下,下列各组离子一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Cl-、K+、HS- | |
| B. | 水电离出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的水溶液中:CH3COO-、CO32-、Na+、K+ | |
| D. | c(Al3+)=1mol/L的溶液中:Na+、NO3-、SO42-、HCO3- |
12.能说明乙醇的结构简式是CH3CH2OH而不是CH3OCH3的事实是( )
| A. | 乙醇能够燃烧 | |
| B. | 乙醇(一定量)与足量金属钠反应放出氢气的量 | |
| C. | 乙醇的分子式是C2H6O | |
| D. | 乙醇的沸点比水的低、密度比水的小 |
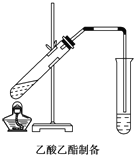 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.