题目内容
8.下列排列顺序错误的是( )| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
分析 A.叁键的键能大于双键的键能,双键的键能大于单键;
B.碳碳单键键长大于碳碳双键,碳碳双键键长大于碳碳三键;
C.炔烃的相对分子质量越大,熔、沸点越大;
D.炔烃的活性大于烯烃,烯烃的活性大于烷烃.
解答 解:A.叁键的键能大于双键的键能,双键的键能大于单键,即键能:C≡C>C=C>C-C,故A正确;
B.碳碳单键键长大于碳碳双键,碳碳双键键长大于碳碳三键,即键长:C-C>C=C>C≡C,故B正确;
C.炔烃的相对分子质量越大,熔、沸点越大,即沸点:C5H8>C4H6>C3H4,故C正确;
D.炔烃的活性大于烯烃,烯烃的活性大于烷烃,即活性:C2H2>C2H4>C2H6,故D错误;
故选D.
点评 本题考查物质性质的比较,涉及键能、键长、沸点、分子活性的比较等,涉及知识点较多,注意归纳规律性知识,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.海洋电池,是以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构.用海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的.海水中只含有0.5%的溶解氧.不放入海洋时,铝极就不会在空气中被氧化,可以长期储存.用时,把电池放入海水中,便可供电,电池设计使用周期可长达一年以上,避免经常交换电池的麻烦.即使更换,也只是换一块铝合金板,电池总反应式:4Al+3O2十6H2O=4Al(OH)3↓下列说法错误的是( )
| A. | 负极铝被氧化 | |
| B. | 海水温度升高,电池反应速率可能加快 | |
| C. | 正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 | |
| D. | 正极电极反应式为O2+4H++4e-=2H2O |
19.美国普林斯顿大学的研究人员利用太阳能电池,通过电解的方法成功地将二氧化碳和水转化为甲酸(HCOOH).下列说法不正确的是( )
| A. | H2O是一种弱电解质 | B. | CO2是一种温室气体 | ||
| C. | HCOOH是一种一元弱酸 | D. | 该研究中能量转化方式只有1种 |
16.下列说法正确的是( )
| A. | 18gH218O含有l0NA个质子 | |
| B. | 过量铁粉在氯气中燃烧生成FeCl2 | |
| C. | 0.1mol•L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+ | |
| D. | 在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS) |
3.设阿伏伽德罗常数为NA,下列说法正确的是( )
| A. | 6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2NA | |
| B. | 用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48L | |
| C. | 一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的数目均为0.01NA | |
| D. | 一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
13. 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
20.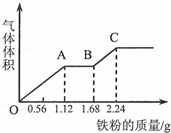 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
17.一定体积某浓度的SnC12溶液与过量FeC13溶液充分混合后,再用0.2000mol/l K2Cr2O7标准溶液滴定.若所需K2Cr2O7溶液的体积恰好是SnCl2溶液的一半,则c(SnC12)为( )
| A. | 0.3000 mol/L | B. | 1.2000 mol/L | C. | 0.0333 mol/L | D. | 0.1333 mol/L |
