题目内容
3.设阿伏伽德罗常数为NA,下列说法正确的是( )| A. | 6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2NA | |
| B. | 用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48L | |
| C. | 一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的数目均为0.01NA | |
| D. | 一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
分析 A、S2、S4、S8均由硫原子构成;
B、MnO2只能与浓盐酸反应,与稀盐酸不反应;
C、CH3COOH是弱电解质,不能完全电离;
D、合成氨的反应为可逆反应.
解答 解:A、S2、S4、S8均由硫原子构成,故6.4gS2、S4、S8混合物中含有的氧原子的物质的量n=$\frac{6.4g}{32g/mol}$=0.2mol,即0.2NA个,故A正确;
B、MnO2只能与浓盐酸反应,与稀盐酸不反应;,故当盐酸变稀时,与MnO2的反应会停止,即盐酸不能反应完全,故生成的氯气的量无法计算,况且选项中所给的氯气所处的状态不明确,不一定是标况,物质的量也不一定是0.2mol,故B错误;
C、CH3COOH是弱电解质,不能完全电离,故两溶液中的CH3COO-的均小于0.01NA个,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,故反应转移的电子的物质的量小于6mol,即小于6NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
相关题目
14.降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
则P1>P3 (填“>”“<”或“=”,下同).若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1<K3.T1、P1时H2的平衡转化率为57.14%.
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
11.下列说法不正确的是( )
| A. | 着火时应立即灭火,一般的小火应用湿布、石棉布或沙子覆盖燃烧物,衣服着火时应迅速脱下衣服或用石棉布覆盖着火处 | |
| B. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 取5 mL 0.1 mol•L-1 KI溶液,滴加0.1 mol•L-1FeCl3溶液5~6滴,再加入2 mL CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变色 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 |
18.下列实验设计或操作正确的是( )
| A. | 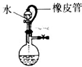 说明该装置气密性良好 | |
| B. |  测定镁铝合金中铝的质量分数 | |
| C. | 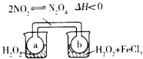 瓶中气体颜色变深,说明H202分解是吸热反应 | |
| D. |  验证苯和溴发生取代反应 |
8.下列排列顺序错误的是( )
| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
13. 下列有关说法正确的是( )
下列有关说法正确的是( )
 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小 | |
| B. | 一定温度下,反应“2HI(g)=H2(g)+I2(g)△H>0”能自发进行,则该反应△S>0 | |
| C. | 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性 | |
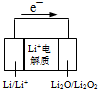
| D. | 如图电池放电时的正极反应式:2Li++Li2O2+2e-=2Li2O |
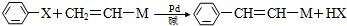 (X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下: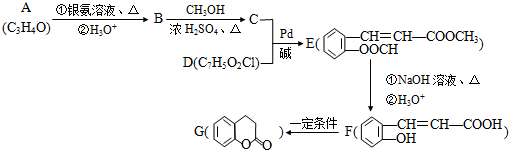
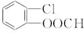 .
.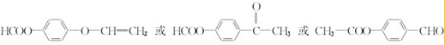 .
. )常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(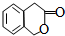 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液. (R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备
(R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备 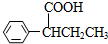 的合成路线流程图如下,请补充完整流程图(无机试剂任选).
的合成路线流程图如下,请补充完整流程图(无机试剂任选).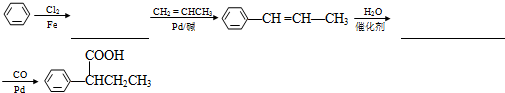
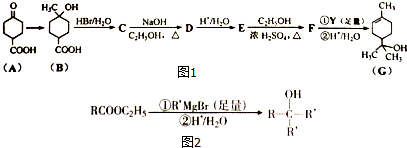
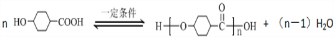 ;
; .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr. Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.