题目内容
18.海洋电池,是以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构.用海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的.海水中只含有0.5%的溶解氧.不放入海洋时,铝极就不会在空气中被氧化,可以长期储存.用时,把电池放入海水中,便可供电,电池设计使用周期可长达一年以上,避免经常交换电池的麻烦.即使更换,也只是换一块铝合金板,电池总反应式:4Al+3O2十6H2O=4Al(OH)3↓下列说法错误的是( )| A. | 负极铝被氧化 | |
| B. | 海水温度升高,电池反应速率可能加快 | |
| C. | 正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 | |
| D. | 正极电极反应式为O2+4H++4e-=2H2O |
分析 根据电池总反应可知,电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,结合原电池的工作原理解答该题.
解答 解:A、电池工作时,负极为Al,发生氧化反应,故A正确;
B、温度升高,离子运动速率加快,电池反应速率可能加快,故B正确;
C、铂做成网状的目的是增大与氧气的接触面积,加快反应速率,故C正确;
D、正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故D错误;
故选D.
点评 本题考查化学电源知识,题目难度中等,注意原电池两极上的变化以及原电池原理.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
8.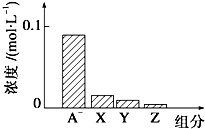 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA溶液显酸性 | |
| B. | 混合溶液中水电离出的C(OH-)、C(H+)相等 | |
| C. | 图中X、Y、Z分别代表OH-、HA-、H+ | |
| D. | 混合溶液中:C(Na+)=C(H2A)+C(HA-)+C(A2-) |
6.25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11.下列说法正确的是( )
| A. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体 | |
| B. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大 | |
| C. | 25℃时,在CaCO3悬浊液中加人NaF固体,CaCO3全部溶解 | |
| D. | 25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大 |
3.某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量.采取的主要操作如图,能达到实验目的是( )


| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
7.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在一定条件下,0.2 mol SO2和0.1 mol O2充分反应,生成SO3的分子数为0.2 NA | |
| B. | 1 L 0.1 mol/L的Na2CO3溶液中阴离子的个数是0.1 NA | |
| C. | 常温常压下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1 NA | |
| D. | 常温常压下,2 g D2O含有的质子数为NA |
8.下列排列顺序错误的是( )
| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
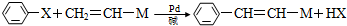 (X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下: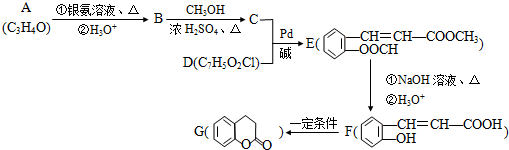
 .
. .
.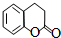 )常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(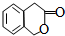 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液. (R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备
(R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备 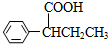 的合成路线流程图如下,请补充完整流程图(无机试剂任选).
的合成路线流程图如下,请补充完整流程图(无机试剂任选).