题目内容
19.美国普林斯顿大学的研究人员利用太阳能电池,通过电解的方法成功地将二氧化碳和水转化为甲酸(HCOOH).下列说法不正确的是( )| A. | H2O是一种弱电解质 | B. | CO2是一种温室气体 | ||
| C. | HCOOH是一种一元弱酸 | D. | 该研究中能量转化方式只有1种 |
分析 A、水是弱电解质存在电离平衡;
B、二氧化碳大量排放容易形成温室效应,是一种温室气体;
C、甲酸是有机羧酸为弱酸;
D、过程中能量转化为光能转化为电能,电能转化为化学能;
解答 解:A、水存在微弱的电离,存在电离平衡是弱电解质,故A正确;
B、二氧化碳大量排放容易形成温室效应,是一种温室气体,故B正确;
C、甲酸是有机羧酸,溶液中存在电离平衡为弱酸,故C正确;
D、过程中能量转化为光能转化为电能,电能转化为化学能,能量转化方式有2种,故D错误;
故选D.
点评 本题考查物质电离程度,弱电解质物质类别的分析应用,主要是能量变化的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
7.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在一定条件下,0.2 mol SO2和0.1 mol O2充分反应,生成SO3的分子数为0.2 NA | |
| B. | 1 L 0.1 mol/L的Na2CO3溶液中阴离子的个数是0.1 NA | |
| C. | 常温常压下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1 NA | |
| D. | 常温常压下,2 g D2O含有的质子数为NA |
14.降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
则P1>P3 (填“>”“<”或“=”,下同).若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1<K3.T1、P1时H2的平衡转化率为57.14%.
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
11.下列说法不正确的是( )
| A. | 着火时应立即灭火,一般的小火应用湿布、石棉布或沙子覆盖燃烧物,衣服着火时应迅速脱下衣服或用石棉布覆盖着火处 | |
| B. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 取5 mL 0.1 mol•L-1 KI溶液,滴加0.1 mol•L-1FeCl3溶液5~6滴,再加入2 mL CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变色 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 |
8.下列排列顺序错误的是( )
| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
9.近年来,我市多地出现了较为严重的雾霾天气,从而再次引起人们对空气质量的关注,下列一些行为和举措,有利于改善空气质量的是( )
| A. | 燃放烟花爆竹 | B. | 大力发展火力发电 | ||
| C. | 露天焚烧垃圾 | D. | 提高电动汽车的比例 |
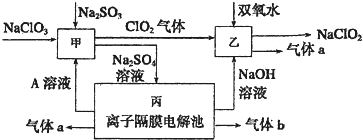
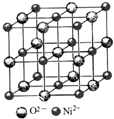 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.