题目内容
20.H、C、N、O、Na、Al、S、Cl Si是常见的元素(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
.
分析 (1)C的原子结构中有2个电子层,最外层电子数为4;
(2)核外电子排布相同的离子,离子核电荷数越大,半径越小;元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;单质的氧化性越强,离子的还原性越弱;同种元素得电子能力相同;
(3)具有相同电子层的为同周期元素,具有3个电子层为第三周期元素;
(4)在(3)中化学反应方程式的元素中、C、N、O位于同周期,原子序数大的非金属性强,可利用气态氢化物的稳定性、与氢气化合的难易程度等比较;
(5)三种元素间可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO等.
解答 解:(1)C元素位于元素周期表第二周期,第IVA族,14C可以测定文物年代,故答案为:第二周期,第IVA族;14C;
(2)N3-、Al3为核外电子排布相同的离子,离子核电荷数越大,半径越小,则N3- 大于Al3+,非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;氧气的氧化性大于硫单质,则O2-小于S2-;同种元素得电子能力相同,故答案为:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3->Al3+ | H2SO4<HClO4 | O2-<S2- | 35Cl=37Cl |
(3)Na、Al、S、Cl、Si均W为第三周期元素,故答案为:Na、Al、S、Cl、Si;
(4)在(3)中非金属元素中、原子序数大的非金属性强,则非金属性为Cl>S>Si,
A.应利用最高价氧化物的水化物的酸性比较,方法不合理,故A不选;
B.气态氢化物的沸点与非金属性无关,故B不选;
C.单质与氢气反应的难易程度,可知非金属得电子的能力,能比较非金属性,故C选;
D.氢化物的稳定性可比较非金属性,故D选;
故答案为:Cl>S>Si;CD;
(5)三种元素间可形成既含离子键又含极性共价键的化合物,如NaOH,其电子式为
 ,故答案为:
,故答案为: .
.点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素周期表、元素周期律、电解质及非金属性比较等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列表示物质结构的化学用语或模型正确的是( )
| A. | 醛基的电子式 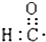 | B. | 丙烷的分子结构的比例模型: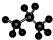 | ||
| C. | 乙烯的最简式(实验式):CH2 | D. | 硝基苯的结构简式: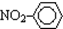 |
11.有人将甲醇设计成为一种燃料电池,并用硫酸作电解质,其中发生的化学反应为:甲醇与氧气反应生成水和二氧化碳(aq表示溶液).该电池负极发生的反应是( )
| A. | CH3OH(g)+O2(g)-2e-=H2O(1)+CO2(g)+2H+(aq) | B. | O2(g)+4H+(aq)+4e-=2H2O(1) | ||
| C. | CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq) | D. | CH3OH(g)+8OH--6e-=CO32-( aq)+6H2O |
8.下列关于化学键的叙述,正确的是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含有极性键的分子一定不含非极性键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负化合价而无正价的元素是F,可用于制半导体材料的元素是Si.
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式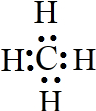 ;
;
(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程: .
.
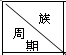 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式
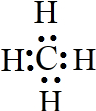 ;
;(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程:
 .
.
5.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )


| A. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 铜片表面有气泡生成 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
9.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示.以下说法不正确的是( )


| A. | X气体为CO2 | |
| B. | 处理后的含硝酸根废水pH降低 | |
| C. | 中间室中的Cl-移向左室 | |
| D. | 电路中每通过1mol电子,产生标准状况下氮气的体积为2.24L |
 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. .
. .
. 已知H2O(g)=H2(g)+$\frac{1}{2}$O2(g),反应过程中能量变化如图所示.请回答下列问题:
已知H2O(g)=H2(g)+$\frac{1}{2}$O2(g),反应过程中能量变化如图所示.请回答下列问题: