题目内容
12. A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.(1)B元素位于元素周期表中第三周期,第ⅥA族.
(2)由元素C与Mg元素形成的化合物的化学键的类型离子键.
(3)由元素A与氢元素形成的化合物的结构式
 .
.(4)由元素B与氢元素形成的化合物的电子式
 .
.(5)写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,结合对应元素的单质、化合物的性质以及元素周期率知识解答该题.
解答 解;A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,
(1)B为S元素,原子核外有3个电子层,最外层电子数为6,则位于周期表第三周期ⅥA族,故答案为:三;ⅥA;
(2)C为F,与Mg元素形成的化合物为MgF2,为离子化合物,含有离子键,故答案为:离子键;
(3)元素N与氢元素形成的化合物为NH3,结构式为 ,故答案为:
,故答案为: ;
;
(4)B为S,与氢元素形成的化合物为H2S,电子式为 ,故答案为:
,故答案为: ;
;
(5)N的气态氢化物为氨气,与S的最高价氧化物对应的水化物硫酸反应生成硫酸铵,化学方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4.
点评 本题考查了元素周期表和元素周期律综合应用,根据元素周期表结构和原子结构分析解答即可,会根据原子结构示意图判断元素在周期表位置,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.相同条件下,下列各组中的两个反应的焓变前者大于后者的是( )
| A. | H2(g)+Cl2(g)=2HCl(g) 和H2(g)+Cl2(g)=2HCl(aq) | |
| B. | C2H4(g)+H2(g)=C2H6(g)和C3H6(g)+H2(g)=C3H8(g) | |
| C. | 2H2(g)+O2(g)=2H2O(l)和2H2(g)+O2(g)=2H2O(g) | |
| D. | C(s)+O2(g)=CO2(g)和C(s)+$\frac{1}{2}$O2(g)=CO(g) |
3.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
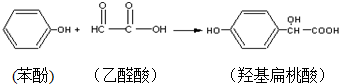
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
20.H、C、N、O、Na、Al、S、Cl Si是常见的元素
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
(3)这些元素中属于第三周期元素的是Na、Al、S、Cl、Si
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
.
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
.
7.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量.已知H-H 键的键能为436kJ•mol-1、Cl-Cl键的键能为243kJ•mol-1、H-Cl键的键能为X,若1molH2(g)与1mol Cl2(g)反应生成2mol HCl(g)放出 183kJ的热量,则X为( )
| A. | 496 kJ•mol-1 | B. | 431 kJ•mol-1 | C. | 862 kJ•mol-1 | D. | 248 kJ•mol-1 |
17.用一定体积、一定浓度的盐酸跟过量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |
1.下列微粒中,电子数目最多的是( )
| A. | H2O | B. | NH3 | C. | Na+ | D. | Al |
2.对于A2+3B2=2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | V(B2)=0.8mol/(L•s) | B. | V(A2)=0.8mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=1.8mol/(L•min) |
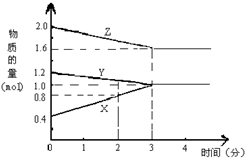 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: