题目内容
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题: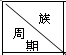 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式
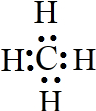 ;
;(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程:
 .
.
分析 根据元素在元素周期表中的位置可知,A、B、C、D、E、F、G、H、I、J分别是H、Na、Al、C、N、P、F、Cl、Ar、Si,
(1)稀有气体性质最不活泼;F元素的非金属性增强,只有正化合价;位于金属和非金属分界线附近的元素能用于作半导体材料;
(2)元素的金属性越强,其最高价氧化物对应的水化物的碱性越强;元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(3)非金属的非金属性越强,其氢化物越稳定;
(4)电子层越多,原子半径越大,电子层相同时,原子序数越大,原子半径越小;
(5)D是C元素,其氢化物为甲烷,甲烷为共价化合物,分子中含有4个碳氢键;
(6)氨气与氯化氢反应生成离子化合物氯化铵,氯化铵中含有离子键和共价键;
(7)BH为NaCl,氯化钠为离子化合物,阴阳离子需要标出所带电荷,据此用电子式表示出其形成过程.
解答 解:A、B、C、D、E、F、G、H、I、J分别为:H、Na、Al、C、N、P、F、Cl、Ar、Si,
(1)稀有气体性质最不活泼,所以化学性质最不活泼的是Ar;F的非金属性最强,则F元素只有负化合价,没有正化合价;位于金属和非金属分界线附近的元素能用于作半导体材料,可用于制半导体材料的元素是Si,
故答案为:Ar;F;Si;
(2)元素的金属性越强,则其最高价氧化物对应的水化物碱性越强,以上各元素中,金属性最强的为Na,则碱性最强的为NaOH;
元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据元素周期律知,非金属性最强的元素是F,但F元素没有含氧酸,非金属性次之的是Cl元素,其最高价含氧酸是HClO4,所以酸性最强的酸是HClO4;
故答案为:NaOH;HClO4;
(3)非金属的非金属性越强,其氢化物越稳定,根据元素周期律知,C、N、P、F、Cl 的非金属性最强的是F元素,所以最稳定的氢化物是HF,
故答案为:HF;
(4)B、C、D、J、E、F、G、H中,D、E、G元素的原子含有2个电子层,B、C、J、F、H原子含有3个电子层,由于B的原子序数最小,则B的原子半径最大,即:原子半径最大的为Na,
故答案为:Na;
(5)D是C元素,其氢化物是甲烷,甲烷属于共价化合物,其电子式为: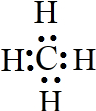 ,故答案为:
,故答案为: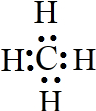 ;
;
(6)E、H的氢化物分别为氨气、HCL,氨气和氯化氢反应生成氯化铵,氯化铵为离子化合物,其化学式中含有离子键和共价键,
故答案为:离子键、共价键;
(7)NaCl为离子化合物,书写电子式时注意,左边写钠原子和氯原子电子式,右边写氯化钠的电子式,中间用箭头连接,用电子式表示氯化钠的形成过程为: ,故答案为:
,故答案为: .
.
点评 本题考查了元素周期律及元素周期表的综合应用,题目难度中等,正确推断元素是解本题关键,根据元素周期律来分析解答即可,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 丁烷与丁烯 | B. | 乙醇与乙醚 | ||
| C. | 丙醛与丙酮 | D. | 2,2-二甲基丙烷与新戊烷 |
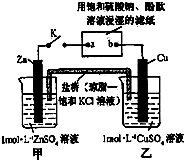
| A. | 片刻后可观察到滤纸a点变红色 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 盐桥中的Cl-向Cu极移动 |
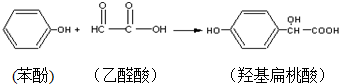
下列有关说法正确的是( )
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
| A | B | C | D | |
| 正极 | Fe | Fe | Cu | Cu |
| 负极 | Cu | Cu | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
. | A. | 496 kJ•mol-1 | B. | 431 kJ•mol-1 | C. | 862 kJ•mol-1 | D. | 248 kJ•mol-1 |
| A. | FeCl2 | B. | Fe(OH)3 | C. | H 2SiO4 | D. | SO3 |
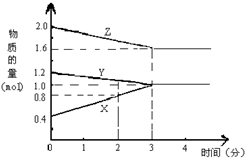 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: