题目内容
8.下列关于化学键的叙述,正确的是( )| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含有极性键的分子一定不含非极性键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
分析 A.含离子键的一定为离子化合物;
B.多原子构成的分子中一定存在化学键;
C.含有极性键的分子,可能含非极性键;
D.含有共价键的化合物可能为离子化合物.
解答 解:A.含离子键的一定为离子化合物,离子化合物中一定含有离子键,故A正确;
B.多原子构成的分子中一定存在化学键,如氢气等,而单原子构成的分子不含化学键,如稀有气体,故B错误;
C.含有极性键的分子,可能含非极性键,如H-O-O-H中含极性键和非极性键,为极性分子,故C错误;
D.含有共价键的化合物可能为离子化合物,如NaOH中含共价键和离子键,故D错误;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及举例法解答此类习题,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
18.已知2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.下列关于该反应的说法中正确的是( )
①该反应是一个放热反应
②参加反应的氢气和氧气的总能量高于反应生成的水的总能量
③该反应是一个吸热反应
④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
①该反应是一个放热反应
②参加反应的氢气和氧气的总能量高于反应生成的水的总能量
③该反应是一个吸热反应
④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
19.如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )
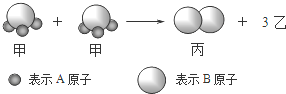

| A. | 1个乙分子中含有2个A原子 | B. | 摩尔质量关系为:2M (甲)=M (乙)+M (丙) | ||
| C. | 该反应一定属于氧化还原反应 | D. | 该反应类型是分解反应 |
16.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是( )
| A. | 氧化钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 氯化铵的分解和氯化钠溶解于水 |
3.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
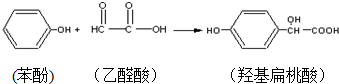
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
20.H、C、N、O、Na、Al、S、Cl Si是常见的元素
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
(3)这些元素中属于第三周期元素的是Na、Al、S、Cl、Si
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: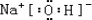 .
.
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
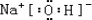 .
.
17.用一定体积、一定浓度的盐酸跟过量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.