题目内容
11.有人将甲醇设计成为一种燃料电池,并用硫酸作电解质,其中发生的化学反应为:甲醇与氧气反应生成水和二氧化碳(aq表示溶液).该电池负极发生的反应是( )| A. | CH3OH(g)+O2(g)-2e-=H2O(1)+CO2(g)+2H+(aq) | B. | O2(g)+4H+(aq)+4e-=2H2O(1) | ||
| C. | CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq) | D. | CH3OH(g)+8OH--6e-=CO32-( aq)+6H2O |
分析 甲醇与氧气反应生成水和二氧化碳(aq表示溶液),可知甲醇中C元素的化合价升高,失去电子被氧化,以此来解答.
解答 解:A.氧气不能在负极上反应,故A不选;
B.氧气在正极上得到电子,为正极反应,故B不选;
C.甲醇失去电子发生氧化反应,则负极反应为CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq),故C选;
D.电解质为酸,而非碱,故D不选;
故选C.
点评 本题考查原电池知识,为高考常见题型,侧重于学生的分析能力和应用能力的考查,注意把握元素的化合价变化及电极反应式的书写,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
1.几种短周期元素的原子半径及主要化合价见表:
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物的水化物的碱性:Y>R>X | |
| D. | 气态氢化物的稳定性:Z>T |
2.相同条件下,下列各组中的两个反应的焓变前者大于后者的是( )
| A. | H2(g)+Cl2(g)=2HCl(g) 和H2(g)+Cl2(g)=2HCl(aq) | |
| B. | C2H4(g)+H2(g)=C2H6(g)和C3H6(g)+H2(g)=C3H8(g) | |
| C. | 2H2(g)+O2(g)=2H2O(l)和2H2(g)+O2(g)=2H2O(g) | |
| D. | C(s)+O2(g)=CO2(g)和C(s)+$\frac{1}{2}$O2(g)=CO(g) |
19.如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )


| A. | 1个乙分子中含有2个A原子 | B. | 摩尔质量关系为:2M (甲)=M (乙)+M (丙) | ||
| C. | 该反应一定属于氧化还原反应 | D. | 该反应类型是分解反应 |
6.将如图所示实验装置的K闭合,下列判断正确的是( )
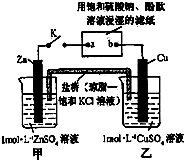

| A. | 片刻后可观察到滤纸a点变红色 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 盐桥中的Cl-向Cu极移动 |
16.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是( )
| A. | 氧化钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 氯化铵的分解和氯化钠溶解于水 |
3.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
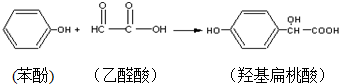
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
20.H、C、N、O、Na、Al、S、Cl Si是常见的元素
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
(3)这些元素中属于第三周期元素的是Na、Al、S、Cl、Si
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
.
(1)C元素位于元素周期表的位置第二周期,第IVA族;C元素的一种同位素可以测定文物年代,这种同位素的符号为14C.
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
(4)在(3)中元素的非金属性由强到弱的顺序为Cl>S>Si,能证明其递变规律的事实是CD(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
(5)H、C、N、O、Na、Cl 三种元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
.
1.下列微粒中,电子数目最多的是( )
| A. | H2O | B. | NH3 | C. | Na+ | D. | Al |