题目内容
7.将下列物质分别加入溴水中,不能使溴水褪色的是( )| A. | Na2SO3晶体 | B. | 乙醇 | C. | C6H6 | D. | Fe |
分析 能使溴水褪色的物质应含有不饱和键或含有醛基等还原性基团的有机物以及或具有还原性或碱性的无机物,反之不能使溴水褪色,以此解答该题.
解答 解:A.Na2SO3具有还原性,可与溴水发生氧化还原反应,故A不选;
B.乙醇与水混溶,且与溴水不发生反应,故B选;
C.溴易溶于苯,溶液分层,水层无色,故C不选;
D.铁可与溴水反应溴化铁,溴水褪色,故D不选.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于考查学生的分析能力和综合运用化学知识的能力,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
17.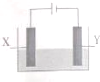 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
( )
 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是( )
| A. | 精炼铜时,电解质为硫酸铜溶液.Y电极反应为:Cu2++2e+=Cu | |
| B. | 精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 | |
| C. | X电极为石墨,Y电极为Cu,则铜收到保护 | |
| D. | X电极为Fe,Y电极为Cu,则铁收到保护 |
18.下列化学现象的描述正确、解释合理的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
15.设NA为伏加的罗常数的值.下列说法正确的是( )
| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
12.在pH=1的酸溶液和pH=13的氢氧化钠溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是( )
| A. | 两溶液体积相同,酸是多元强酸 | |
| B. | 两溶液体积相同,酸是弱酸 | |
| C. | 酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上 | |
| D. | 酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上 |
19.第三周期元素的原子中,未成对电子不可能有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
16.将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生.针对上述变化,下列分析正确的是( )
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
17.化学与生活、社会密切相关.下列有关说法正确的是( )
| A. | 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖 | |
| B. | 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜 | |
| C. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 |