题目内容
12.下列有关说法中错误的是( )| A. | 用NaOH溶液滴定醋酸时,可用酚酞试液作指示剂 | |
| B. | 花生油、菜子油漕油等水解时可得到一种共同的产物 | |
| C. | NH3+HCl=NH4Cl能自发进行,其△H一定小于零 | |
| D. | 甲烷和氯气反应与苯和硝酸反应的反应类型不同 |
分析 A.醋酸与NaOH溶液恰好反应时溶液显碱性;
B.花生油、菜子油、猪油均属于油脂;
C.△H-T△S<0时反应能自发进行;
D.甲烷和氯气反应、苯与硝酸反应均是取代反应.
解答 解:A.醋酸与NaOH溶液恰好反应时生成醋酸钠,溶液显碱性,酚酞的变色范围在碱性区间,所以可用酚酞试液作指示剂,故A正确;
B.花生油、菜子油、猪油均属于油脂,油脂水解时均可得到甘油,故B正确;
C.△H-T△S<0时反应能自发进行,已知NH3+HCl=NH4Cl是一个熵值减小的反应即△S<0,故只有△H<0时反应才能发生,故C正确;
D.甲烷和氯气反应属于取代反应,苯与硝酸反应属于取代反应,二者反应类型相同,故D错误.
故选D.
点评 本题考查了中和滴定、油脂的水解产物、反应自发性的判断、有机反应类型等,题目难度不大,侧重于基础知识的考查,注意对基础知识的积累.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
1.元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A. | 第1列中的碱金属和第17列元素的单质熔、沸点变化趋势相同 | |
| B. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| C. | 在整个18列元素中,第14列元素形成的化合物种类最多 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
19. 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | 整个过程中阳极先产生Cl2,后产生O2 | |
| D. | CD段表示的电解过程中水的电离被促进 |
7.①制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
17.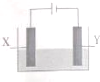 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
( )
 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是( )
| A. | 精炼铜时,电解质为硫酸铜溶液.Y电极反应为:Cu2++2e+=Cu | |
| B. | 精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 | |
| C. | X电极为石墨,Y电极为Cu,则铜收到保护 | |
| D. | X电极为Fe,Y电极为Cu,则铁收到保护 |
4.下列说法不正确的是( )
| A. | 碳化硅可作砂纸、砂轮的磨料 | |
| B. | 地沟油没有利用价值,可用燃烧法处理 | |
| C. | 食盐、食醋、纯碱、小苏打是常见的厨房用品 | |
| D. | 开发和利用太阳能是节约化石能源,弥补能源不足的途径 |
1.已知A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)A有8、9、10个中子的三种核素,它们之间称同位素,B在元素周期表的位置:第二周期VA族,B的氢化物水溶液显碱性的原因NH3+H2O=NH3•H2O=NH4++OH-.
(2)C的原子结构示意图为 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |