题目内容
17.化学与社会、生产、生活紧密相关,下列说法正确的是( )| A. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| B. | 自来水可用氯气来杀菌消毒.说明氯气无毒 | |
| C. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
分析 A.“绿色化学”的核心就是要利用化学原理从源头消除污染;
B.氯气是有毒的气体;
C.纯碱是生产玻璃的原料之一,油脂在碱性条件下可发生水解反应;
D.海水晒盐是物理变化.
解答 解:A.“绿色化学”的核心就是要利用化学原理从源头消除污染,而不是对污染进行治理,故A错误;
B.自来水可用氯气来杀菌消毒,是氯气和水反应生成强氧化性物质次氯酸,但氯气是有毒的气体,故B错误;
C.纯碱可用于生产普通玻璃,纯碱水解显碱性,能使油脂水解,故日常生活中也可用纯碱溶液来除去物品表面的油污,故C正确;
D.从海水中提取某些物质可以通过物理变化实现,如海水晒盐,故D错误;
故选C.
点评 本题考查了绿色化学的核心、氯气和纯碱的用途、物质变化等知识,难度不大,注意对绿色化学相关知识的梳理.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
7.①制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
8.下列各组物质中,属于同分异构体的一组是( )
| A. |  和 和 | B. | 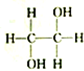 和 和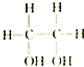 | C. | 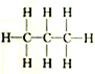 和 和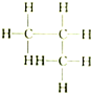 | D. | CH3-CH2-CHO和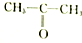 |
5.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 78g苯含有C=C键的数目为3NA | |
| B. | 室温时,8g SO3分子中氧原子的数目为0.3NA | |
| C. | 在反应中KClO4+8HCl=KCl+4Cl2↑+4H2O,每生成4molCl2转移的电子数目为8NA | |
| D. | 1molFeCl2与足量氯气反应时转移的电子数为2NA |
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
9.铊(Tl)与铝同族.Tl3+在酸性溶液中能发生反应:Tl3++2Ag→Tl++2Ag+.下列推断错误的是( )
| A. | Tl+的最外层有1个电子 | B. | Tl能形成+3价和+1价的化合物 | ||
| C. | 酸性溶液中Tl3+比Tl+氧化性强 | D. | Tl+的还原性比Ag弱 |
6.将1mol过氧化钠与2mol碳酸氢钠固体混合,在密闭容器中,120℃充分反应后,排出气体,冷却,有固体残留.下列分析正确的是( )
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |