题目内容
13.某pH=1的X溶液中可能含有Fe2+、Al3+,NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )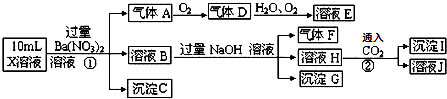
| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |
分析 pH=1的溶液显强酸性,故溶液中一定不会存在CO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;,H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;
根据溶液的电中性可知,不能确定是否含有的离子还有Cl-,以此解答.
解答 解:pH=1的溶液显强酸性,而强酸性溶液中一定不会存在CO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;由于溶液中已经有SO42-,故Cl-可有可无,不能确定.
故溶液中一定存在:H+、Fe2+、NH4+、SO42-;一定不存在:CO32-;不能确定的是:A13+、Cl-;
A、气体A为NO,故A错误;
B、依据分析可知:溶液中一定存在:Fe2+、NH4+、SO42-,A13+存在不能确定,故B错误;
C、溶液E为HNO3,气体F为NH3,二者能反应生成硝酸铵,故C错误;
D、A13+和Cl-不能确定,故D正确.
故选D.
点评 本题考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,注意溶液电中性的利用.

练习册系列答案
相关题目
4.下列说法不正确的是( )
| A. | 碳化硅可作砂纸、砂轮的磨料 | |
| B. | 地沟油没有利用价值,可用燃烧法处理 | |
| C. | 食盐、食醋、纯碱、小苏打是常见的厨房用品 | |
| D. | 开发和利用太阳能是节约化石能源,弥补能源不足的途径 |
1.已知A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)A有8、9、10个中子的三种核素,它们之间称同位素,B在元素周期表的位置:第二周期VA族,B的氢化物水溶液显碱性的原因NH3+H2O=NH3•H2O=NH4++OH-.
(2)C的原子结构示意图为 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
8.下列各组物质中,属于同分异构体的一组是( )
| A. | 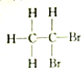 和 和 | B. | 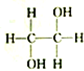 和 和 | C. | 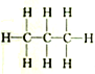 和 和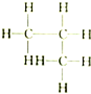 | D. | CH3-CH2-CHO和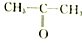 |
18.下列化学现象的描述正确、解释合理的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 78g苯含有C=C键的数目为3NA | |
| B. | 室温时,8g SO3分子中氧原子的数目为0.3NA | |
| C. | 在反应中KClO4+8HCl=KCl+4Cl2↑+4H2O,每生成4molCl2转移的电子数目为8NA | |
| D. | 1molFeCl2与足量氯气反应时转移的电子数为2NA |
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
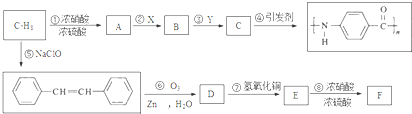
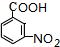 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有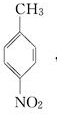 和
和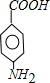 .(填结构简式)
.(填结构简式)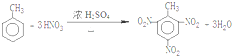 .
.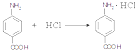 .
.