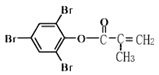
题目内容
【题目】实验室制备纯碱的主要步骤如流程所示:

四种盐在不同温度下的溶解度(g/100gH2O)表
温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:温度高于35℃时NH4HCO3会分解,请回答:
(1)下列操作或描述正确的是________。
A.温度控制在30-35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢
B.保温30min的目的是使反应充分进行
C.过滤后的滤液只有NH4Cl和NH4HCO3溶质
D.洗去晶体表面的杂质可以选用蒸馏水
(2)反应温度控制在30~35℃,为控制此温度范围,采取的加热方法为______________。
(3)常温时,过滤后主要得到NaHCO3晶体的原因是______________。
(4)灼烧NaHCO3晶体的装置为________。
A.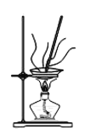 B.
B.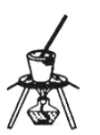 C.
C.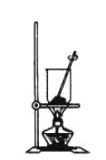
(5)洗涤NaHCO3晶体的操作______________。
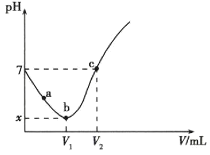
(6)测定纯碱产品中NaHCO3含量的方法:准确称取纯碱样品Wg放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点)所用HCl溶液体积为V1mL。再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______________。
【答案】ABD 水浴加热 因为在所有反应物和生成物中,碳酸氢钠在该温度下的溶解度最小 B 向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次 ![]() ×100%
×100%
【解析】
(1)A.温度控制在30~35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢,故A正确;
B.保温30min的目的是使反应充分进行,故B正确;
C.过滤后的滤液有NH4Cl、NH4HCO3、NaCl、NaHCO3溶质,故C错误;
D.洗去晶体表面的杂质操作为:向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次,可以用蒸馏水,故D正确;故答案选:ABD;
(2)反应温度控制在30~35℃,需采用水浴加热法,故答案为:水浴加热;
(3)通过表格中溶解度分析常温时, NaHCO3溶解度最小,故过滤后主要得到NaHCO3晶体,故答案为:因为在所有反应物和生成物中,碳酸氢钠在该温度下的溶解度最小;
(4)灼烧晶体应在坩埚中进行,A为蒸发皿,B为坩埚,C为烧杯,故答案选:B;
(5)洗涤NaHCO3晶体的操作为向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次,故答案为:向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次;
(6)样品中与碳酸氢钠反应消耗盐酸的物质的量![]() mol,根据离子方程式HCO3-+H+=CO2↑+H2O可知NaHCO3物质的量
mol,根据离子方程式HCO3-+H+=CO2↑+H2O可知NaHCO3物质的量![]() mol,则NaHCO3的质量
mol,则NaHCO3的质量![]() g,纯碱样品中NaHCO3质量分数为
g,纯碱样品中NaHCO3质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
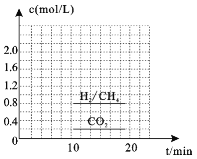
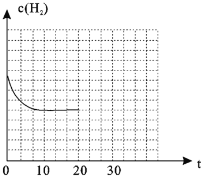
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
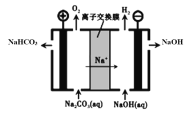
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。