题目内容
【题目】Ⅰ.某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得到固体,用稀盐酸溶解,然后加试剂调节溶液的pH,经系列操作可得氯化铜晶体。请回答:
(1)电解精炼粗铜时,阴极发生的电极反应为__________。
(2)调节溶液pH的合适试剂为__________。
A.CuO B.Na2CO3 C.Cu2(OH)2CO3 D.稀氨水
(3)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热后生成CuCl沉淀,写出离子方程式__________。
Ⅱ.某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8gB和气体单质C,单质C在标准状况下的密度为1.25g·L-1。请回答下列问题:
(4)A中所含的元素为__________(用元素符号表示)。
(5)写出A隔绝空气加强热的反应方程式__________。
(6)写出SCl2与氨反应的化学方程式__________。
【答案】Cu2++2e-=Cu A、C 2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+ S、N S4N4![]() 4S+2N2↑ 6SCl2+16NH3=S4N4+2S+12NH4Cl
4S+2N2↑ 6SCl2+16NH3=S4N4+2S+12NH4Cl
【解析】
(1)电解精炼粗铜时粗铜为阳极,精铜为阴极,电解质为CuSO4,阴极电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)调节溶液pH消耗剩余的HCl,除去Fe3+,不能带入新的杂质, 可用CuO或Cu2(OH)2CO3,Na2CO3带入新的离子Na+,稀氨水带入新的离子NH4+,故答案选:AC;
(3)CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热后生成CuCl沉淀,CuSO4中Cu化合价由+2价下降为+1价,为氧化剂,则还原剂为Na2SO3,氧化产物为Na2SO4,则离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
Ⅱ.SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7,则B为S;X为NH4Cl;将18.4gA隔绝空气加强热可得到12.8gB和气体单质C,单质C在标准状况下的密度为1.25g·L-1。单质C的摩尔质量![]() ,则单质C为N2;18.4gA含S元素12.8g,N元素5.6g,则S与N的个数比
,则单质C为N2;18.4gA含S元素12.8g,N元素5.6g,则S与N的个数比![]() , A的相对分子质量为184则A的分子式为:S4N4。
, A的相对分子质量为184则A的分子式为:S4N4。
(4)A中所含的元素为S、N,故答案为:S、N;
(5)A隔绝空气加强热生成N2和S,反应方程式为:![]() ;
;
(6)SCl2与氨反应生成A、S和NH4Cl,反应方程式为:![]() ,故答案为:
,故答案为:![]() 。
。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
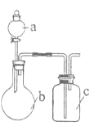
智趣寒假作业云南科技出版社系列答案【题目】利用如图实验装置进行相关实验,能得出相应实验结论的是( )
a | b | c | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa溶液 | 酸性:碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯和液溴发生取代反应 | |
C | 浓盐酸 | 酸性KMnO4溶液 | 碘化钾溶液 | 氧化性:Cl2>I2 | |
D | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 乙炔具有还原性 |
A.AB.BC.CD.D
【题目】实验室制备纯碱的主要步骤如流程所示:

四种盐在不同温度下的溶解度(g/100gH2O)表
温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:温度高于35℃时NH4HCO3会分解,请回答:
(1)下列操作或描述正确的是________。
A.温度控制在30-35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢
B.保温30min的目的是使反应充分进行
C.过滤后的滤液只有NH4Cl和NH4HCO3溶质
D.洗去晶体表面的杂质可以选用蒸馏水
(2)反应温度控制在30~35℃,为控制此温度范围,采取的加热方法为______________。
(3)常温时,过滤后主要得到NaHCO3晶体的原因是______________。
(4)灼烧NaHCO3晶体的装置为________。
A.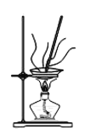 B.
B.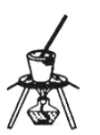 C.
C.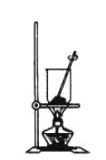
(5)洗涤NaHCO3晶体的操作______________。
(6)测定纯碱产品中NaHCO3含量的方法:准确称取纯碱样品Wg放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点)所用HCl溶液体积为V1mL。再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______________。