题目内容
6.草酸(H2C3O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验.实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
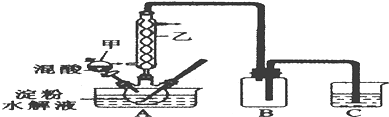
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C8H12O6+12HNO3═3H3C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是安全瓶(或防止C中液体倒吸进A中)
(2)如何检验该装置的气密性:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热,C装置中应加入NaOH溶液.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液溶于锥形瓶中,将0.10mol/L酸性KMnO4溶液装在酸式滴定管(填仪器名称)中进行滴定,达到滴定终点时的现象是溶液由无色变为紫色,且半分钟不褪色.
若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为90%.
分析 (1)反应生成的气体与C中氢氧化钠溶液反应,容易发生倒吸现象,装置B为安全瓶,起到了防止倒吸的作用;
(2)把分液漏斗的活塞关闭,然后把导管插入C中,稍稍加热A,根据C中产生的现象判断装置的气密性;
(3)该反应中产生的二氧化氮、NO有毒,需要用氢氧化钠溶液吸收;
(4)酸性高锰酸钾溶液具有强氧化性,能够将草酸氧化,据此写出反应的离子方程式;
(5)对比试验1和试验2的反应条件的区别,可以得出影响化学反应速率的因素;
(6)酸性高锰酸钾溶液具有强氧化性,应该选用酸式滴定管盛放;根据滴定结束前溶液为无色、滴定结束后溶液变成紫色判断滴定终点;结合酸性高锰酸钾的物质的量及反应的离子方程式计算出反应中消耗的草酸的物质的量,再计算出草酸的纯度.
解答 解:(1)反应中生成的二氧化氮、NO能够与氢氧化钠溶液反应生成亚硝酸钠,容易发生倒吸现象,装置B为安全瓶,可以防止C中液体倒吸入A中,
故答案为:安全瓶(或防止C中液体倒吸进A中);
(2)检验该装置的气密性方法为:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好,
故答案为:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好;
(3)反应生成的气体为二氧化氮和NO,二者都有毒,需要使用尾气吸收装置,二氧化氮和一氧化氮能够与氢氧化钠溶液反应生成亚硝酸钠,所以C中的液体可以为NaOH溶液,
故答案为:水浴加热;NaOH;
(4)酸性高锰酸钾具有强氧化性,草酸能够被氧化,导致酸性高锰酸钾溶液褪色,反应的离子方程式为:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O;
(5)通过两组实验比较知,其它条件相同,试验2中加入硫酸锰,其反应时间短,说明反应速率快,从而证明反应生成的Mn2+有催化作用,加快了反应速率,
故答案为:生成的Mn2+对此反应起催化剂的作用;
(6)酸性高锰酸钾溶液具有强氧化性,不能使用碱式滴定管盛放,应该选用酸式滴定管盛放酸性高锰酸钾溶液;滴定过程中,高锰酸根离子完全反应,溶液为无色,草酸完全反应后,高锰酸根离子过量,溶液呈紫色,所以滴定终点的现象为:溶液由无色变为紫色,且半分钟不褪色;
20mL 0.1mol/L的高锰酸钾的物质的量为:0.1mol/L×0.02L=0.002mol,根据反应5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O可知,5.0g该草酸样品中含有草酸的物质的量为:0.002mol×$\frac{5}{2}$=0.005mol,该样品中草酸的纯度为:$\frac{90g/mol×0.05mol}{5.0g}$×100%=90%,
故答案为:酸式滴定管;溶液由无色变为紫色,且半分钟不褪色;90%.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,注意掌握化学实验基本操作方法,明确常见物质的性质及化学实验方案设计原则.

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | CS2 | B. | CH4 | C. | CH3CH2Cl | D. | CH≡CH |
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| D. | 用硝酸银溶液直接检验溴乙烷中的溴元素 |
| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点.
| A. | ①②④ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |

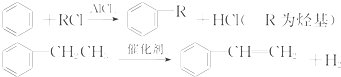 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是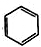 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$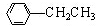 +HCl.
+HCl.