题目内容
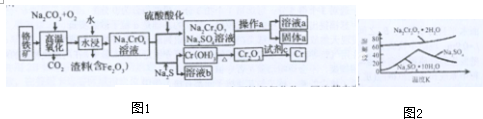
18.国家发展改革委员会于数年前就发出“遏制铝冶炼投资反弹”的紧急通知.原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失.下面是铝和氧化铝生产的流程图:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠(偏铝酸钠在水溶液中以Na[Al(OH)4]的形式存在)反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2Na[Al(OH)4]=Na2Al2Si2O3↓+4NaOH+2H2O
请回答下列问题:
(1)在工业电解铝的过程中,用石油炼制和煤的干馏产品中的石墨(填物质名称)作电解铝的阴极和阳极材料.
(2)氧化铝的熔点高达2050℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是加入冰晶石(物质名称).
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是在电解过程中该电极材料不断被消耗,当生成2.16t铝时,最多消耗阳极1.44t.
(4)图中滤液A的主要成分为Fe2O3、Na2Al2Si2O8;滤渣A的用途有作为炼铁的原料或生产硅酸盐产品(写一种).
(5)在生产氧化铝流程第三步“酸化”中,加入的最佳物质A是CO2.理由是二氧化碳过量时氢氧化铝不会溶解,反应易控制且廉价.
(6)镁和铝都是活泼金属,在电解冶炼镁、铝原料的选取中,镁用氯化物、铝用氧化物的原因是因为氧化镁熔点太高,氯化镁熔点低,熔化时能发生电离导电,氯化铝是共价化合物熔化时不发生电离不能导电.
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)冶炼铝的电解槽中的阴极和阳极材料均为惰性电极;
(2)氧化铝的熔点很高,在铝的冶炼中要加入冰晶石可以降低氧化铝的熔化温度;
(3)依据电极反应和电子守恒计算,阳极消耗是因为电解过程中生成的氧气和电极材料碳发生反应当生成一氧化碳时消耗碳最多;
(4)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,依据滤渣的组成分析判断A的用途;
(5)第三步中,选用二氧化碳作酸化剂,可将Al元素全部转化为沉淀,氢氧化铝不溶于弱酸;
(6)氧化镁熔点高,氯化镁熔点低,氯化铝为共价化合物,熔化后不导电,而氧化铝为离子化合物.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)冶炼铝的电解槽中的阴极和阳极材料均为惰性电极,在工业电解铝的过程中,用石油炼制和煤的干馏产品中的石墨作电解铝的阴极和阳极材料,
故答案为:石墨;
(2)氧化铝的熔点很高,工业上为了降低能量消耗,在铝的冶炼中要加入冰晶石可以降低氧化铝的熔化温度,
故答案为:冰晶石;
(3)阳极消耗是因为电解过程中生成的氧气和电极材料碳发生反应生成二氧化碳,阳极电极反应为:2O2--4e-=O2↑,阴极电极反应为Al3++3e-=Al,结合电子守恒得到3O2~4Al,电极消耗反应生成一氧化碳时压强消耗的碳最多,2C+O2=2CO,
当生成2.16t铝时消耗阳极
6C~3O2~4Al
6×12 4×27
m 2.16t
m=1.44t,
故答案为:1.44;
(4)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,图中滤液A的主要成分为Fe2O3、Na2Al2Si2O8 ,依据滤渣的组成分析判断A的用途可以做炼铁的原料或生产硅酸盐产品,
故答案为:Fe2O3、Na2Al2Si2O8 ,炼铁的原料或生产硅酸盐产品;
(5)第三步“酸化”中,选用二氧化碳作酸化剂,过量的二氧化碳通入偏铝酸钠溶液中可将Al元素全部转化为氢氧化铝沉淀,因为氢氧化铝不溶于弱酸碳酸,且二氧化碳来源广,反应易控制廉价,
故答案为:CO2,二氧化碳过量时氢氧化铝不会溶解,反应易控制且廉价;
(6)氧化镁熔点高,氯化镁熔点低,熔融后电离出离子能导电,工业冶炼镁是电解熔融的氯化镁,氯化铝为共价化合物,熔化后不导电,而氧化铝为离子化合物熔融可以电离出离子能导电,工业冶炼铝是电解熔融的氧化铝冰晶石熔融体,
故答案为:因为氧化镁熔点太高,氯化镁熔点低,熔化时能发生电离导电,氯化铝是共价化合物熔化时不发生电离不能导电.
点评 本题考查Al及其化合物的化学性质、物质分离提纯方法和基本操作的综合应用,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.

| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是
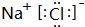 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
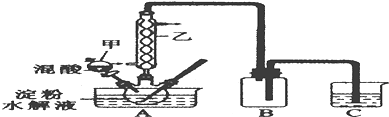
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C8H12O6+12HNO3═3H3C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是安全瓶(或防止C中液体倒吸进A中)
(2)如何检验该装置的气密性:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热,C装置中应加入NaOH溶液.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液溶于锥形瓶中,将0.10mol/L酸性KMnO4溶液装在酸式滴定管(填仪器名称)中进行滴定,达到滴定终点时的现象是溶液由无色变为紫色,且半分钟不褪色.
若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为90%.
| A. | 排布在K、L、M三个电子层上 | B. | 3p能级上有2个空轨道 | ||
| C. | 共有16种不同的运动状态 | D. | 共有5种不同的能级 |
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1min-1.
(3)如果反应所用的H2O2溶液为100mL,则0─80min共产生O2Cg.
A.0.08 B.0.16 C.1.2 D.2.4.
 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用: