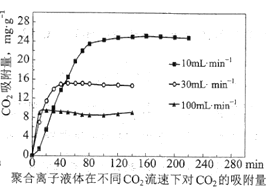
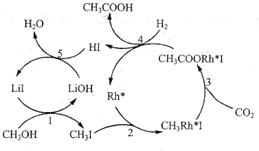
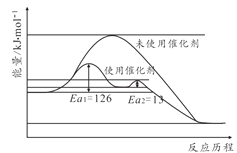
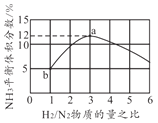
题目内容
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式为
 ,它属于
,它属于
A. 芳香烃B. 易溶于水的有机物C. 苯甲酸的同系物D. 高分子化合物
【答案】C
【解析】
从结构可判断该有机物属于芳香酸,不属于烃类。与苯甲酸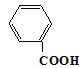 相差了6个CH2原子团,属于同系物。因含有碳原子个数较多,烃基部分较长,因此在水中溶解度较小。以此解题。
相差了6个CH2原子团,属于同系物。因含有碳原子个数较多,烃基部分较长,因此在水中溶解度较小。以此解题。
A. 该有机物含有氧原子,因此不属于烃类,A项错误;
B. 该有机物中含有碳原子个数较多,烃基部分较大、属于憎水基,因此该物质在水中溶解度较小,B项错误;
C. 该有机物与苯甲酸 均属于一元芳香酸,相差了6个CH2原子团,属于同系物,C项正确;
均属于一元芳香酸,相差了6个CH2原子团,属于同系物,C项正确;
D. 该有机物的摩尔质量未达到104g/mol,不属于高分子化合物,D项错误;
答案应选C。

【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了a~f6元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | a | b | ||||||
三 | c | d | e | f |
回答下列问题
(1)写出a单质的电子式________。
(2)画出b的原子结构示意图:__________。
(3)写出c单质和水反应的化学方程式:__________。
(4)金属性c强于
(5)已知硒(Se)与e同主族,且位于e的下一个周期,根据硒元素在元素周期表中的位置推测硒及其化合物可能具有的性质是______。
①最高价氧化物对应的水化物的化学式为H2SeO3
②SeO2既有氧化性又有还原性
③气态氢化物的稳定性比e元素的弱
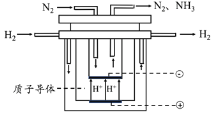
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。