题目内容
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
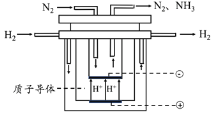
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。
【答案】![]() 氮气与氢气反应的限度(或化学平衡常数)远大于氮气与氧气反应的 放热 d 提高合成氨反应的化学反应速率 变大 N2 + 6e- + 6H+=2NH3
氮气与氢气反应的限度(或化学平衡常数)远大于氮气与氧气反应的 放热 d 提高合成氨反应的化学反应速率 变大 N2 + 6e- + 6H+=2NH3
【解析】
(1)根据化学平衡常数等于生成物浓度系数次方之积比反应物浓度系数次方之积书写平衡常数表达式;
(2)根据表格数据,通过比较氮气与氢气和氮气与氧气两个反应的平衡常数回答;
(3)①根据表格数据,升高温度,氨的平衡含量减小,结合温度对平衡的影响分析判断;②其他条件不变时,温度升高氨的平衡含量减小,是因为升高温度,平衡逆向移动的结果,据此分析判断;③尽管降低温度有利于氨的合成,但温度越低,反应速率越慢,建立平衡需要的时间越长,据此分析解答;
(4)再平衡体系中再充入1 mol氮气和3 mol 氢气,相当于增大压强,结合压强对平衡的影响分析解答;
(5)电解法合成氨,根据图示,阴极上氮气得到电子生成了氨气,据此书写电极反应式。
(1)化学平衡常数等于生成物浓度系数次方之积比反应物浓度系数次方之积,故N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为K=
2NH3(g)的化学平衡常数表达式为K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
(2)根据表格数据,氮气与氢气反应的限度(或化学平衡常数)远大于氮气与氧气反应的,因此工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮,故答案为:氮气与氢气反应的限度(或化学平衡常数)远大于氮气与氧气反应的;
(3)①根据表格数据,升高温度,氨的平衡含量减小,说明N2(g)+3H2(g)![]() 2NH3(g)平衡逆向移动,因此正反应为放热反应,故答案为:放热;
2NH3(g)平衡逆向移动,因此正反应为放热反应,故答案为:放热;
② a. 温度升高,正反应速率和逆反应速率均增大,故a错误;b. 温度升高,压强不变,浓度商(Q)不变,但K减小,使得Q > K,平衡逆向移动,故b错误;c. 温度升高,活化分子数百分数增大,活化分子数增多,反应速率加快,但没有解释氨的平衡含量减小的原因,故c错误;d. 温度升高,K变小,平衡逆向移动,使得氨的平衡含量减小,故d正确;故选d;
③尽管降低温度有利于氨的合成,但温度越低,反应速率越慢,建立平衡需要的时间越长,因此哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是提高合成氨反应的化学反应速率,故答案为:提高合成氨反应的化学反应速率;
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,相当于增大压强,N2(g)+3H2(g)![]() 2NH3(g)平衡正向移动,氮气的平衡转化率变大,故答案为:变大;
2NH3(g)平衡正向移动,氮气的平衡转化率变大,故答案为:变大;
(5)根据图示,电解法合成氨,阴极上氮气得到电子生成了氨气,电极反应式为N2 + 6e- + 6H+ =2NH3,故答案为:N2 + 6e- + 6H+ =2NH3。