题目内容
【题目】德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。合成氨为解决世界的粮食问题作出了重要贡献。其原理为N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol
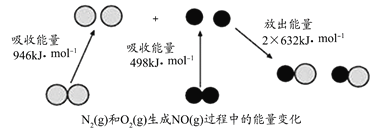
(1)若已知H-H键的键能为436.0kJ/mol,N-H的键能为390.8kJ/mol,则N![]() N的键能约为_____kJ/mol
N的键能约为_____kJ/mol
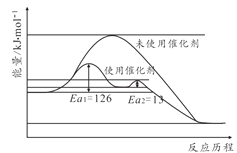
(2)合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由______决定(填“第一步反应”或者“第二步反应”),未使用催化剂时逆反应活化能______正反应活化能(填“大于”“小于”或者“等于”)
(3)从平衡和速率角度考虑,工业生产采取20MPa到50MPa的高压合成氨原因______
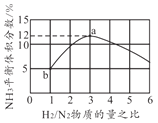
(4)一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点______b点(填"大于”“小于”或者“等于”)。若起始压强为20MPa,则b点时体系的总压强约为______MPa。
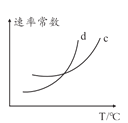
(5)若该反应的正逆反应速率分别表示为v正=K正![]() ,v逆=K逆c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
,v逆=K逆c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
(6)常温下,向20mL的0.1mol/L的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(NH4+)=_______
【答案】944.4 第一步反应 大于 当压强低于20MPa时,反应速率慢,且反应转化率低,压强过大于50MPa时,转化率提升不大,但对设备的要求高,生产成本高 小于 19 ![]() K正 K逆 0.1mol/L
K正 K逆 0.1mol/L
【解析】
(1)根据反应热的计算公式![]() ,可得
,可得![]() ,故答案为:944.4;
,故答案为:944.4;
(2)因为第一步反应的活化能大于第二步反应的活化能,则催化剂后整个反应的速率由第一步反应决定,由图可知未使用催化剂时逆反应活化能大于正反应活化能,故答案为:第一步反应;大于;
(3)根据工业上制备氨气的原理可知,当压强低于20MPa时,反应速率慢,且反应转化率低,压强过大于50MPa时,转化率提升不大,但对设备的要求高,生产成本高,所以工业生产采取20MPa到50MPa的高压合成氨,故答案为:当压强低于20MPa时,反应速率慢,且反应转化率低,压强过大于50MPa时,转化率提升不大,但对设备的要求高,生产成本高;
(4)当增大氢气的用量时,氮气的转化率升高,氢气的转化率降低,则H2的转化率a点小于b点;根据图知b点氨气的体积分数为5%,设氮气与氢气在恒容密闭容器中各投1mol,转化的氮气为xmol,则可列三段式为:
N2+3H22NH3
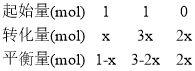
则有![]() ,
,![]() ,由此可得x=
,由此可得x= ![]() ,P(平衡)=19MPa,故答案为:小于;19;
,P(平衡)=19MPa,故答案为:小于;19;
(5)平衡时,正反应速率=逆反应速率,则有![]() ,平衡常数K=
,平衡常数K= 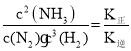 ;该反应为放热反应,温度升高时,平衡会逆向移动,平衡常数会减小,则K逆大于K正,c代表K正,d代表K逆,故答案为:
;该反应为放热反应,温度升高时,平衡会逆向移动,平衡常数会减小,则K逆大于K正,c代表K正,d代表K逆,故答案为:![]() ;K正;K逆;
;K正;K逆;
(6)反应后溶液呈中性,溶液中c(H+)=c(OH-)且由电荷守恒c(H+)+c(NH4+)=c(OH-)+c(Cl-),则c(NH4+)= c(Cl-)=0.1mol/L,故答案为:0.1mol/L。

 阅读快车系列答案
阅读快车系列答案