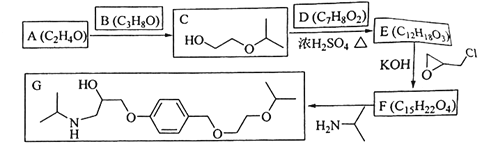
题目内容
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了a~f6元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | a | b | ||||||
三 | c | d | e | f |
回答下列问题
(1)写出a单质的电子式________。
(2)画出b的原子结构示意图:__________。
(3)写出c单质和水反应的化学方程式:__________。
(4)金属性c强于
(5)已知硒(Se)与e同主族,且位于e的下一个周期,根据硒元素在元素周期表中的位置推测硒及其化合物可能具有的性质是______。
①最高价氧化物对应的水化物的化学式为H2SeO3
②SeO2既有氧化性又有还原性
③气态氢化物的稳定性比e元素的弱
【答案】![]()
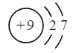
![]() 钠和镁电子层数相同,但是钠的核电荷数比镁少,钠原子半径大,原子核对最外层电子引力小,失电子能力强,钠金属性强 ②③
钠和镁电子层数相同,但是钠的核电荷数比镁少,钠原子半径大,原子核对最外层电子引力小,失电子能力强,钠金属性强 ②③
【解析】
由元素在周期表中的位置可知a为N、b为F、c为Na、d为Mg、e为S、f为Cl,据此分析,
(1)a的单质为氮气,其电子式为:![]() ,
,
故答案为:![]() ;
;
(2)b为F,其原子结构示意图为![]() ,
,
故答案为:![]() ;
;
(3)c的单质为钠单质,钠与水反应产生氢氧化钠和氢气,反应方程式为![]() ,
,
故答案为:![]() ;
;
(4)金属性Na强于Mg,因为钠和镁是同周期元素,电子层数相同,但钠的核电荷数比镁少,钠原子半径大,原子核对最外层电子引力小,失电子能力强,钠金属性强,
故答案为:钠和镁电子层数相同,但是钠的核电荷数比镁少,钠原子半径大,原子核对最外层电子引力小,失电子能力强,钠金属性强;
(5) 硒(Se)与S同主族,则Se的最外层电子数为6,其最高化合价为+6价;Se位于S的下一个周期,则Se的非金属性比S弱,①其最高化合价为+6价,最高价氧化物对应的水化物的化学式为H2SeO4,故错误;②SeO2中Se为+2价,处于Se的中间价态,根据价态规律,元素化合价处于中间价态时既有氧化性又有还原性,故正确;③Se的非金属性比S弱,非金属性越强气态氢化物越稳定,则Se的气态氢化物的稳定性比S元素的弱,故正确;
故答案为:②③。

 名校课堂系列答案
名校课堂系列答案