题目内容
【题目】实验小组进行如下实验:
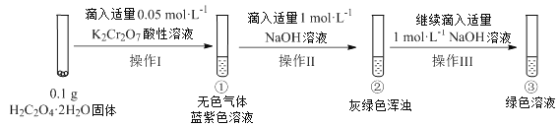
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
A. ①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B. 若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
C. 将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D. 操作I中产生的无色气体是CO
【答案】D
【解析】
往H2C2O4·2H2O固体中滴入适量的K2Cr2O7酸性溶液,发生反应的化学方程式为:2K2Cr2O7+6H2C2O4+8H2SO4=2K2SO4+2Cr2(SO4)3+12CO2↑+14H2O,生成Cr2(SO4)3为蓝紫色溶液,无色气体为CO2,滴入适量的NaOH溶液,生成Cr(OH)3为灰绿色固体,可以看到
灰绿色浑浊,继续滴加NaOH溶液,可以看到灰绿色浑浊溶解,生成绿色的CrO2-,据此答题。
A.①中发生反应的化学方程式为:2K2Cr2O7+6H2C2O4+8H2SO4=2K2SO4+2Cr2(SO4)3+12CO2↑+14H2O,K2Cr2O7中Cr元素的化合价由+6价→+3价,化合价降低,作氧化剂,表现为氧化性,故A正确;
B.向蓝紫色Cr2(SO4)3溶液中,加入NaOH溶液至析出灰绿色沉淀,此时,溶液中存在着如下平衡Cr3+(蓝紫色)+3OH-Cr(OH)3(灰绿色)CrO2-(绿色)+H++H2O,加入稀硫酸,会增大氢离子浓度,平衡向逆反应方向移动,溶液显蓝紫色,故B正确;
C.①溶液中含有Cr3+,③溶液中含有CrO2-,Cr3+与CrO2-双水解,反应的离子方程式为:Cr3++3CrO2- +6H2O=4Cr(OH)3↓,会产生灰绿色浑浊,故C正确;
D.由反应方程式2K2Cr2O7+6H2C2O4+8H2SO4=2K2SO4+2Cr2(SO4)3+12CO2↑+14H2O可知,操作I中产生的无色气体是CO2,故D错误。
故选D。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因
素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并
用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是_______。
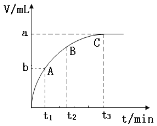
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
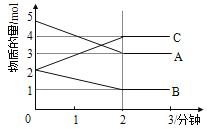
(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为________。