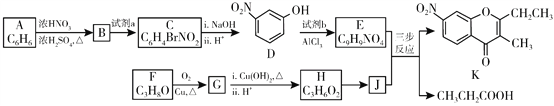
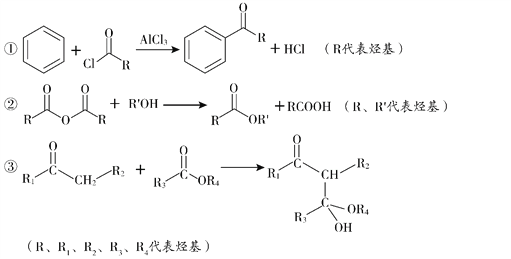
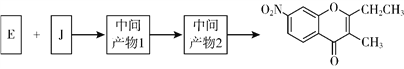
题目内容
【题目】资源化利用![]() ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)![]() 的捕集:
的捕集:
①![]() 属于___________分子(填“极性”或“非极性”),其晶体(干冰)属于__________晶体。
属于___________分子(填“极性”或“非极性”),其晶体(干冰)属于__________晶体。
②用饱和![]() 溶液做吸收剂可“捕集”
溶液做吸收剂可“捕集”![]() 。若所得溶液
。若所得溶液![]() ,溶液中
,溶液中![]() _______;(室温下,
_______;(室温下,![]() 的
的![]() )若吸收剂失效,可利用
)若吸收剂失效,可利用![]() 溶液使其再生,写出该反应的离子方程式_____。
溶液使其再生,写出该反应的离子方程式_____。
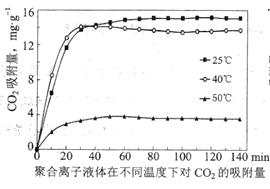
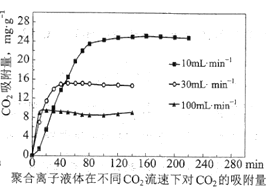
③聚合离子液体是目前广泛研究的![]() 吸附剂。结合下图分析聚合离子液体吸附
吸附剂。结合下图分析聚合离子液体吸附![]() 的有利条件是____________。
的有利条件是____________。
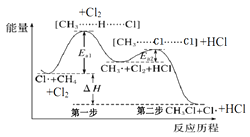
(2)生产尿素:工业上以![]() 、
、![]() 为原料生产尿素
为原料生产尿素![]() ,该反应分为二步进行:
,该反应分为二步进行:
第一步:![]()
![]()
第二步:![]()
![]()
写出上述合成尿素的热化学方程式_______。
(3)合成乙酸:中国科学家首次以![]() 、
、![]() 和
和![]() 为原料高效合成乙酸,其反应路径如图所示:
为原料高效合成乙酸,其反应路径如图所示:
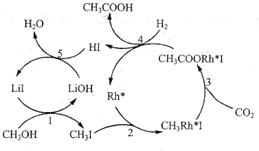
①原料中的可通过电解法由![]() 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成![]() 的电极反应式:____________。
的电极反应式:____________。
②根据图示,写出总反应的化学方程式:_______。
【答案】非极性 分子 ![]()
![]() 低温,低流速(或25℃,
低温,低流速(或25℃,![]() )
) ![]()
![]()
![]()
【解析】
(1)①极性分子是指分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,而非极性分子是指原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子,![]() 是非金属氧化物,其结构式为:O=C=O,属于非极性分子,干冰是固态二氧化碳,属于分子晶体,故答案为:非极性;分子。
是非金属氧化物,其结构式为:O=C=O,属于非极性分子,干冰是固态二氧化碳,属于分子晶体,故答案为:非极性;分子。
②根据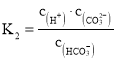 ,
,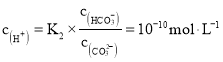 ,则
,则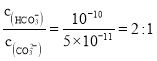 ;饱和Na2CO3溶液做吸收剂“捕集”CO2生成NaHCO3而失效,NaHCO3是酸式盐,能与NaOH反应生成Na2CO3和H2O,其离子反应方程式为:HCO3+OH=H2O+CO32,故答案为:2:1;HCO3+OH=H2O+CO32。
;饱和Na2CO3溶液做吸收剂“捕集”CO2生成NaHCO3而失效,NaHCO3是酸式盐,能与NaOH反应生成Na2CO3和H2O,其离子反应方程式为:HCO3+OH=H2O+CO32,故答案为:2:1;HCO3+OH=H2O+CO32。
③观察图1可知,温度相对越低、气体流速越慢,聚合离子液体吸附CO2越彻底、效果越好,即吸附CO2的有利条件温度为25℃或低温,气体流速为10mLmin1或低流速,故答案为:低温,低流速(或25℃,10mLmin1)。
(2)已知:①![]()
![]() ;
;
②![]()
![]() ;
;
根据盖斯定律,①+②可得合成尿素的热化学方程式:![]() ,故答案为:
,故答案为:![]() 。
。
(3)①电解时CO2在阴极得到电子生成CH3OH,结合酸性条件写出阴极电极反应式为:![]() ,故答案为:
,故答案为:![]() 。
。
②根据图示可知,CH3OH、CO2和H2在LiI、![]() 作用下生成了乙酸,根据原子守恒写出化学反应方程式为:
作用下生成了乙酸,根据原子守恒写出化学反应方程式为:![]() ,故答案为:
,故答案为:![]() 。
。

 目标测试系列答案
目标测试系列答案【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
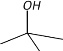
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用降温结晶的方法可将叔丁醇从二者的混合物中结晶出来
D. 两种醇发生消去反应后得到同一种烯烃