题目内容
【题目】一种合成某药物中间体Z的方法如下,下列说法正确的是( )

A. 1 mol X最多能消耗溴水中的2 mol Br2
B. Y可以发生消去反应
C. Y中所有原子可以在同一平面
D. 用FeCl3溶液可以检验Z中是否混有X
【答案】D
【解析】
A.苯环上羟基的邻位和对位氢原子能够被溴取代, 1 mol X最多能消耗溴水中的3mol Br2,故A错误;
B. Y中含有氯原子,在碱性条件下可以发生水解反应,与氯原子相连的碳原子的邻位碳原子上没有氢原子,不能发生消去反应,故B错误;
C.苯环是平面结构,单键可以旋转,但饱和碳原子所连的4个原子一定不在同一平面上,所以 Y中所有原子不可能在同一平面,故C错误;
D. X中含有酚羟基,遇FeCl3溶液显紫色,Z中不含酚羟基,故可用FeCl3溶液可以检验Z中是否混有X,故D正确。
故答案选D。

【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构信息及性质信息如表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成 | X的氢化物水溶液呈碱性 |
Y | Y原子的最外层电子数是其内层电子数的两倍 | Y能形成多种气态氢化物 |
Z | Z原子有三个电子层 | 含有Z元素的化合物的焰色反应呈黄色 |
W | W原子的最外层电子数等于(2n+1)(n为原子核外电子层数) | W和Z能按1∶1的原子个数比形成离子化合物 |
请按要求回答下列问题:
(1)W在元素周期表中的位置是______。
(2)X简单气态氢化物的分子式为______。(用化学式表示)
(3)X、Y、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______。(用化学式表示)
(4)Z单质在W单质中发生反应的实验现象是______。
(5)写出W的单质与二氧化硫的混合气体通入水中所发生反应的离子方程式:______。
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下图所示:
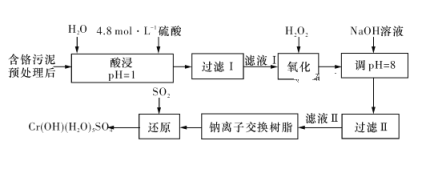
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸__________mL;配制时所用玻璃仪器除量筒、烧杯、胶头滴管和玻璃棒外,还需____________。
(2)“酸浸”时,为了提高浸取率可采取的措施有__________________。
(3)H2O2的作用是将“滤液Ⅰ”中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。过滤后“滤液Ⅱ”中的阳离子主要有Na+、Ca2+、Mg2+,但溶液的pH不能超过8,其理由是__________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR===MRn+nNa+,利用钠离子交换树脂除去“滤液Ⅱ”中的金属阳离子是________(填离子符号)。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:___________________。