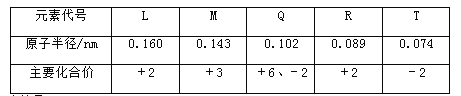
题目内容
【题目】把下列现象中硫酸所表现出来的性质填写在空白处:
(1)把锌粒放入稀硫酸中时,有气体放出 _____________;
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 _____________;
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑 _____________;
(4)把木炭放入热的浓硫酸中时,有气体放出 _____________;
(5)在常温下可以用铁、铝制容器盛装冷的浓硫酸 _____________。
【答案】 酸性 吸水性 脱水性 强氧化性或氧化性 强氧化性或氧化性
【解析】(1)Zn+H2SO4=ZnSO4+H2↑,该反应中H元素化合价由+1价变为0价、Zn元素化合价由0价变为+2价,反应生成硫酸锌和氢气,反应生成硫酸盐,体现其酸性,且H元素的化合价降低,体现其弱氧化性;(2)在烧杯中敞口放置浓硫酸时,质量增加,是因浓硫酸具有吸水性;(3)用玻璃棒蘸浓硫酸滴在纸上时,纸发黑,是因浓硫酸具有脱水性,使纸中H、O元素以水的形式脱出,留下C元素;(4)浓硫酸和碳反应方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,该反应中浓硫酸体现强氧化性;(5)浓硫酸具有强氧化性,能和铁、铝在常温下发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步反应,该现象为钝化现象,浓硫酸体现强氧化性。
CO2↑+2SO2↑+2H2O,C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,该反应中浓硫酸体现强氧化性;(5)浓硫酸具有强氧化性,能和铁、铝在常温下发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步反应,该现象为钝化现象,浓硫酸体现强氧化性。

练习册系列答案
相关题目