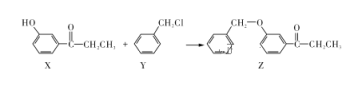
题目内容
【题目】(一) 某实验小组的同学们用下列装置进行乙醇催化氧化的实验.(部分夹持仪器已略去)已知:乙醇的沸点为 78℃,易溶于水;乙醛的沸点为 20.8℃,易溶于水。
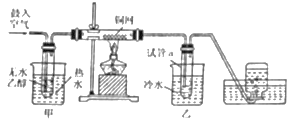
(1) 乙醇催化氧化的化学方程是_________。
(2)装置甲中热水的主要作用是_________。
(3)装置乙中冷水的主要作用是_________,其温度要求是_________,为达到该温度,可进行的操作是_________。
(4)实验开始前,加热铜网,观察到的现象是_________,该反应的化学方程式是_________;鼓入空气和乙醇蒸气后,铜网处观察到的现象是_________,此反应中,铜的作用是_________。
(5) 在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应_________(填“吸热”或“放热”);集气瓶中收集到的气体的主要成分是_________。
(6)实验结束后,取出装置乙中的试管,打开橡胶塞,能闻到_________。
(二) 化学兴趣小组的同学们设计了如下装置验证乙醇催化氧化的产物(加热仪器、夹持装置已略
去)。
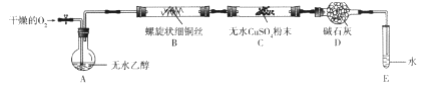
已知: 乙醇的沸点为 78℃, 易溶于水; 乙醛的沸点为 20.8℃, 易溶于水。
(1)乙醇催化氧化的化学方程式是___________。
(2)实验时上述装置中需要加热的是__________(填字母,下同),其中应该先加热的是_______, 为使装置A中的乙醇成为蒸气, 最简单的加热方法是_________。
(3)实验室制取氧气的化学方程式是___________。
(4)实验开始后,装置B中能观察到的现象是___________;装置C中能观察到的现象是__________, 由此得出的结论是_____________。
(5)装置 E 的作用是________, 能初步判定反应后有乙醛生成的依据是_____________。
(6)装置 D中的药品是__________, 其作用是_________________。
【答案】(一)![]() 加热乙醇,使其成为蒸气 冷凝乙醛 小于20.8℃ 向水中加入少量冰块 铜网变黑
加热乙醇,使其成为蒸气 冷凝乙醛 小于20.8℃ 向水中加入少量冰块 铜网变黑 ![]() 变黑的铜网重新变红 催化剂 放热 氮气 强烈的刺激性气味
变黑的铜网重新变红 催化剂 放热 氮气 强烈的刺激性气味
(二) ![]() AB B 水浴加热
AB B 水浴加热 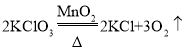 铜丝由红变黑,再由黑变红 无水硫酸铜粉末由白色变为蓝色 乙醇催化氧化的产物有水 吸收乙醛 防止倒吸 装置E中的物质有强烈刺激性气味 碱石灰 防止外界的水蒸气进入导管使无水硫酸铜变蓝
铜丝由红变黑,再由黑变红 无水硫酸铜粉末由白色变为蓝色 乙醇催化氧化的产物有水 吸收乙醛 防止倒吸 装置E中的物质有强烈刺激性气味 碱石灰 防止外界的水蒸气进入导管使无水硫酸铜变蓝
【解析】
本实验主要考察的是乙醇的催化氧化。在课本中,乙醇的催化氧化的实验操作是将灼烧过的铜丝插入到乙醇中。在本题的两个实验中,乙醇放置在一个装置中,无法直接和铜网(丝)接触,且题中告知乙醇的沸点,则可以使用气态的乙醇去反应。在实验(一)中,装置甲的作用是提供气态的乙醇,装置乙的作用是收集乙醛(题中告知乙醛的沸点为20.8℃,说明乙醛也易挥发)。在实验(二)中,装置A的作用是提供气态的乙醇,装置C的作用是检验产物——水蒸气,装置D的作用是干燥乙醛,装置E的作用是收集乙醛(乙醛易溶于水)。还要注意的是,乙醇的催化氧化实际上是两步反应,Cu先被氧化为CuO,乙醇和灼热的CuO反应生成乙醛和Cu。
(一)(1)乙醇催化氧化的化学方程式为:![]() ;
;
(2)由于乙醇无法直接和铜网接触,所以需要将乙醇汽化,装置甲中的热水是为了加热乙醇,使其变为蒸汽;
(3)题中告知乙醛的沸点为20.8℃,易溶于水,说明乙醛易挥发,可以用水吸收乙醛,则装置乙中冷水的作用是吸收乙醛,温度小于20.8℃,以减少乙醛的挥发;为了保证低温,往往考虑使用冰水浴,所以可以在冷水中加入少量冰块;
(4)铜网受热,可以看到铜网变黑,其化学方程式为![]() ;鼓入乙醇蒸汽后,乙醇和黑色的CuO在加热的情况下反应,CuO变回了Cu,则可以观察到黑色的铜网变红;在整个过程中,Cu先是变为CuO,再是变回了Cu,相当于没有发生变化,起到了催化剂的作用;
;鼓入乙醇蒸汽后,乙醇和黑色的CuO在加热的情况下反应,CuO变回了Cu,则可以观察到黑色的铜网变红;在整个过程中,Cu先是变为CuO,再是变回了Cu,相当于没有发生变化,起到了催化剂的作用;
(5)反应需要加热进行,在熄灭酒精灯的情况下,反应仍能进行,说明有热量提供以满足该反应的需要,则该反应是放热反应;整个反应过程中,涉及到的气体有空气、乙醇气体、乙醛气体,其中乙醇气体参与反应或者被乙装置吸收,乙醛气体被乙装置吸收,空气中的氧气参与反应,氮气不参加任何反应,则集气瓶中主要的成分为氮气;
(6)乙装置中的主要液体为乙醛溶液,打开瓶塞后,可以闻到强烈的刺激性气味;
(二)(1)乙醇催化氧化的化学方程式为:![]() ;
;
(2)该反应的条件为加热,,所以B处需要加热,实验中还需要乙醇气体,所以A处也需要加热,则需要加热的有A、B;该反应的实际情况中,乙醇是和CuO反应的,所以要先加热B以获得CuO;为使乙醇变为蒸气,最简单的方法是水浴加热,因为水浴加热时,乙醇受热均匀,可以获得平稳的乙醇气流;
(3)实验室制备干燥的O2的方程为: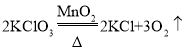 ;
;
(4)实验开始后,Cu先变为CuO,CuO再和乙醇气体反应变回Cu,所以B处可以看到红色的铜丝先变黑,再变红;反应中,有水蒸气生成,则可以看到C处的无水CuSO4粉末变为蓝色,说明该反应有水生成;
(5)E的作用为吸收乙醛,因为题中已经告知乙醛的沸点为20.8℃,且易溶于水,且E装置在反应装置的最后;乙醛具有刺激性气味,所以可以根据气味来判断是否有乙醛生成;
(6)D中的药品应该是碱石灰,因为E中含有水,水蒸气会沿导管进入C中,这样会影响无水CuSO4粉末对产物生成的水的检验,所以应该在C、E之间连接一个干燥装置,目的是防止防止外界的水蒸气进入导管使无水CuSO4粉末变蓝。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案【题目】二氯化二硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭。生产中使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量氯气即可生成S2Cl2,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下表所示:
水溶性 | 密度(g/cm3) | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | -76 ℃ | 138 ℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | -122 ℃ | 59 ℃ |
实验室可用如图所示装置制备少量S2Cl2。请回答下列问题:
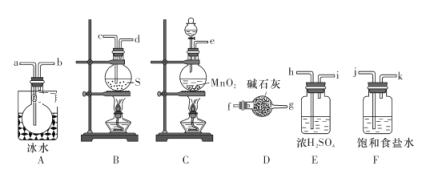
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为__________。
(2)从上图所示装置中选用某一装置制取Cl2,发生反应的离子方程式为__________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为:
e→______→_____→______→______→______→______→a→b→______→_______(按气流方向填小写字母代号)。
(4)仪器D的名称是__________,D中碱石灰的作用是__________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是_______。
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式:__________;该反应中被氧化和被还原的元素的质量之比为______。