题目内容
【题目】磷的单质和化合物在科研与生产中有许多重要用途,铜及其合金是人类最早使用的金属材料。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为______。
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是__________ ,1mol[Cu(NH3)4]SO4 有___mol配位键 ;②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
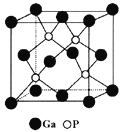
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式) ______g·cm-3(NA为阿伏加德罗常数)。
【答案】6 4 正四面体形 < P原子的3p3为半充满状态,较稳定 第四周期ⅠB族 4 ACE 4 ![]()
【解析】
根据白磷的分子结构和核外电子排布情况分析分子中的成键情况;根据价层电子对互斥理论分析分子的空间构型;根据晶胞的结构特点计算晶胞的密度。
(1)根据白磷分子结构可知,P最外层有5个电子,4个P原子形成了正四面体结构,有六对成键电子对,4对孤电子对;
(2)PCl4+中P原子含有的孤对电子对数=![]() =0,即不存在孤电子对,由于P原子的价层电子对数是4,所以空间构型是正四面体;
=0,即不存在孤电子对,由于P原子的价层电子对数是4,所以空间构型是正四面体;
(3)元素的非金属性越强,电负性越大,所以电负性:P<S,由于P原子的核外电子排布:[Ne]3s23p3,其中3p3轨道是半满状态,比较稳定,故P的第一电离能比S大;
(4) ① Cu元素原子核外电子数为29,外围电子排布式为3d104s1,则铜位于第四周期第IB族元素; [Cu(NH3)4]SO4 中铜离子提供空轨道,氮原子提供孤电子对,故1mol[Cu(NH3)4]SO4 有4mol配位键,;②[Cu(NH3)4]SO4中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键, [Cu(NH3)4]2+与SO42-之间是离子键,故答案选ACE;
(5) 与Ga紧邻的P个数为4个,从该晶胞的结构可知,一个晶胞中含有Ga原子的数目:8![]() +6
+6![]() =4个,P原子个数为:4,晶胞的体积为:(a
=4个,P原子个数为:4,晶胞的体积为:(a![]() )3cm3,晶胞的密度为:
)3cm3,晶胞的密度为:![]() ;故答案为: 4 ,
;故答案为: 4 , ![]() 。
。

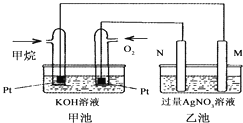
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。