题目内容
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下图所示:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸__________mL;配制时所用玻璃仪器除量筒、烧杯、胶头滴管和玻璃棒外,还需____________。
(2)“酸浸”时,为了提高浸取率可采取的措施有__________________。
(3)H2O2的作用是将“滤液Ⅰ”中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。过滤后“滤液Ⅱ”中的阳离子主要有Na+、Ca2+、Mg2+,但溶液的pH不能超过8,其理由是__________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR===MRn+nNa+,利用钠离子交换树脂除去“滤液Ⅱ”中的金属阳离子是________(填离子符号)。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:___________________。
【答案】65.2 250mL容量瓶 升高温度(加热)、搅拌(任选一点,或其他合理答案) 2Cr3++3H2O2+H2O===Cr2O72-+8H+ pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(Ⅲ)的回收与再利用 Ca2+、Mg2+ 3SO2+2Na2CrO4+12H2O===2Cr(OH)(H2O)5SO4↓+Na2SO4+2NaOH
【解析】
(1)应配制溶液的体积为250mL,根据稀释定律,求出需量取浓硫酸的体积;
依据溶液配制的步骤和过程分析所用到的仪器;
(2)酸浸时溶解物质,为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等。
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-,溶液pH=8,Fe3+、Al3+沉淀完全,滤液Ⅱ中主要阳离子为Na+、Ca2+、Mg2+;pH超过8时,氢氧化铝是两性氢氧化物会溶解于强碱溶液中,影响铬离子的回收利用。
(5)根据框图转化关系可知,滤液Ⅱ中主要阳离子为Na+、Ca2+、Mg2+,钠离子交换树脂就是对滤液Ⅱ进行离子交换,交换的离子是Ca2+和Mg2+。
(6)SO2具有还原性,被滤液Ⅱ中通过离子交换后的溶液中的Na2CrO4氧化为H2SO4,Na2CrO4被还原为Cr(OH)(H2O)5SO4,水溶液中生成NaOH溶液和H2SO4反应生成Na2SO4据此写出化学方程式。
(1)应配制溶液的体积为250mL,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×4.8mol/L,解得:x=65.2mL;
依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管,配制一定物质的量浓度的溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、容量瓶和胶头滴管,题中给出信息要配制250mL硫酸溶液,故容量瓶应选用250mL容量瓶。
故答案为:65.2 ;250mL容量瓶;
(2)酸浸时溶解物质,为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等。
故答案为:升高温度(加热)、搅拌(任选一点,或其他合理答案);
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式:2Cr3++3H2O2+H2O===Cr2O72-+8H+;
故答案为:2Cr3++3H2O2+H2O===Cr2O72-+8H+;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-,溶液pH=8,Fe3+、Al3+沉淀完全,滤液Ⅱ中主要阳离子为Na+、Ca2+、Mg2+;pH超过8时,氢氧化铝是两性氢氧化物会溶解于强碱溶液中,影响铬离子的回收利用。
故答案为:pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(Ⅲ)的回收与再利用;
(5)根据框图转化关系可知,滤液Ⅱ中主要阳离子为Na+、Ca2+、Mg2+,钠离子交换树脂就是对滤液Ⅱ进行离子交换,交换的离子是Ca2+和Mg2+。
故答案为:Ca2+、Mg2+;
(6)SO2具有还原性,被滤液Ⅱ中通过离子交换后的溶液中的Na2CrO4氧化为H2SO4,Na2CrO4被还原为Cr(OH)(H2O)5SO4,水溶液中生成NaOH溶液和H2SO4反应生成Na2SO4,该反应方程式表面上看十分复杂,其实只需运用原子守恒法即可配平该反应方程式:
3SO2+2Na2CrO4+12H2O===2Cr(OH)(H2O)5SO4↓+Na2SO4+2NaOH,
故答案为:3SO2+2Na2CrO4+12H2O===2Cr(OH)(H2O)5SO4↓+Na2SO4+2NaOH。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
【题目】二氯化二硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭。生产中使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量氯气即可生成S2Cl2,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下表所示:
水溶性 | 密度(g/cm3) | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | -76 ℃ | 138 ℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | -122 ℃ | 59 ℃ |
实验室可用如图所示装置制备少量S2Cl2。请回答下列问题:
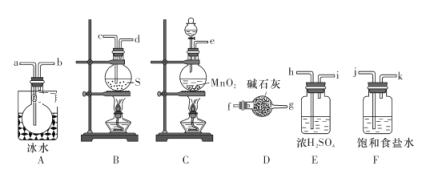
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为__________。
(2)从上图所示装置中选用某一装置制取Cl2,发生反应的离子方程式为__________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为:
e→______→_____→______→______→______→______→a→b→______→_______(按气流方向填小写字母代号)。
(4)仪器D的名称是__________,D中碱石灰的作用是__________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是_______。
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式:__________;该反应中被氧化和被还原的元素的质量之比为______。