题目内容
8.下列关系正确的是( )| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H2O>溴苯> | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
分析 A.碳氢比小的氢的质量分数大;
B.溴苯密度比水大,苯密度比水小;
C.烃类物质中,烃含有的C原子数目越多,相对分子质量越大,熔沸点越高,同分异构体分子中,烃含有的支链越多,分子间的作用力越小,熔沸点越小;
D.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$).
解答 解:A.苯,乙烯,甲烷的碳氢比分别为:1:1;1:2:1:4,氢的质量分数:甲烷>乙烯>苯,故A错误;
B.溴苯密度比水大,苯密度比水小,则密度为溴苯>H2O>苯,故B错误;
C.烃类物质中,烃含有的C原子数目越多,相对分子质量越大,熔沸点越高,同分异构体分子中,烃含有的支链越多,分子间的作用力越小,熔沸点越小,所以熔点:戊烷>2一甲基丁烷>2,2一二甲基丙烷,故C正确;
D.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$);显然甲烷消耗氧气最多,大小顺序为乙烷>乙烯>乙炔,故D错误;
故选C.
点评 本题考查学生利用燃烧通式的计算及物理性质的比较,注意规律的应用是解答本题的关键,要求学生学会归纳总结,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.已知AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |
3.X、Y、Z为短周期元素,X的单质与水在常温条件下就能剧烈反应生成一种还原性气体,Y的最高价氧化物对应的水化物是一种酸性最强的酸;Z与Y同周期且只能形成ZY3;X、Z的简单离子核外电子排布相同.下列有关叙述正确的是( )
| A. | 离子半径:X>Y>Z | B. | 最外层电子数:Y>Z>X | ||
| C. | 原子序数:Z>Y>X | D. | 单质熔点:X>Z>Y |
13.下列有关实验操作对应的现象及对现象的解释或所得出的结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp(Mg(OH)2)>Ksp(Cu(OH)2) |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
20.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
| A. | 有机物一定含有碳元素,所以含碳元素的化合物一定是有机物 | |
| B. | 置换反应中有单质生成,所以有单质生成的反应一定属于置换反应 | |
| C. | 含碳元素的物质在O2中充分燃烧会生成CO2,所以在O2中燃烧能生成CO2的物质一定含碳元素 | |
| D. | 盐的组成中含有金属阳离子与酸根离子,所以盐中一定不含氢元素 |
17.如图是草酸溶液中H2C2O4、HC2O4-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量被度和的比值)与pH的关系图,下到有关说法不正确的是( )
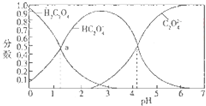

| A. | pH=5的溶液中c(C2O42-)>c(HC2O4-) | |
| B. | NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| C. | 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中2c(Na+)=c(HC2O4-)+c(H2C2O4) | |
| D. | 为使溶液中c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
18.氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响.铵盐在工农业生产、生活中有着重大作用.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
则该反应的平衡常数K1>K2(填“>”、“<”或“=”).
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
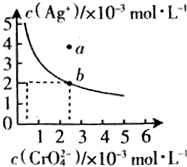 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.