题目内容
17.已知AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为( )| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |
分析 向AgCl与 AgBr的饱和溶液中,加入AgNO3,AgCl与AgBr的溶解平衡向左移动,但AgBr的溶解度更小,溶液中AgCl沉淀较多.
解答 解:在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,
故选C.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,解答本题时注意AgCl的溶解度比AgBr大,加入硝酸银,抑制溶解平衡向右移动,生成沉淀更多.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.其他条件不变时,能使反应速率加快的是( )
| A. | 对于反应Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,增大体系的压强 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入Ar | |
| C. | 对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入N2 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g),容器气体压强不变时,充入Ar |
8.下列对相应微粒的描述中,不正确的是( )
| A. | 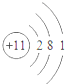 易形成阳离子 | B. | 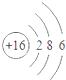 易得电子 | C. |  为稳定结构 | D. | 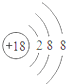 稀有气体的原子 |
12.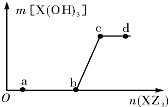 向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | d点对应的溶液中:K+、NH4+、CO32-、I- | |
| B. | c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ | |
| C. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| D. | a点对应的溶液中:Na+、K+、SO42-、HCO3- |
2.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子序数依次减小 | D. | P、S、Cl最高正价依次升高 |
8.下列关系正确的是( )
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H2O>溴苯> | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
 ,写出HFO的结构式H-O-F.
,写出HFO的结构式H-O-F.