题目内容
17.如图是草酸溶液中H2C2O4、HC2O4-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量被度和的比值)与pH的关系图,下到有关说法不正确的是( )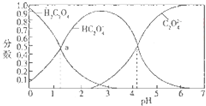
| A. | pH=5的溶液中c(C2O42-)>c(HC2O4-) | |
| B. | NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| C. | 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中2c(Na+)=c(HC2O4-)+c(H2C2O4) | |
| D. | 为使溶液中c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
分析 A、图象分析可知pH>4.2后,溶液中c(C2O42-)>c(HC2O4-);
B、NaHC2O4溶液中电荷守恒和物料守恒计算得到质子守恒分析;
C、a点时,溶液中碳微粒只有HC2O4-、H2C2O4且二者浓度相等,物料守恒计算分析;
D、图象分析可知PH=2.7左右c(HC2O4-)最大,体积分数接近90%左右.
解答 解:A、由图中曲线变化分析可知,pH>4.2后,溶液中一定存在c(C2O42-)>c(HC2O4-),故A正确;
B、NaHC2O4溶液中电荷守恒,c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),物料守恒c(Na+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),得到质子守恒:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4),故B正确;
C、a点时,溶液中碳微粒只有HC2O4-、H2C2O4且二者浓度相等,物料守恒c(Na+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故C错误;
D、由图象分析可知PH=2.7左右c(HC2O4-)最大,故D正确.
故选C.
点评 本题考查了图象分析方法和变化特征的分析判断,电解质溶液中离子浓度大小比较、电荷守恒、物料守恒的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
8.下列关系正确的是( )
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H2O>溴苯> | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
5.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
| W | X | ||
| Y | Z |
| A. | W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料 | |
| B. | Z元素的最高价氧化物水化物的酸性强于Y | |
| C. | 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定 | |
| D. | 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性 |
12.对下列化学用语描述和理解都正确的是( )
| A. | 原子结构示意图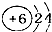 ,可以表示12C,也表示14C ,可以表示12C,也表示14C | |
| B. | 比例模型 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 | |
| C. | 结构示意图为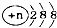 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
2.分子式为C8H11N的有机物,分子内含有苯环和氨基(-NH2)的同分异构体共有( )
| A. | 13种 | B. | 12种 | C. | 14种 | D. | 9种 |
9.根据有机化合物的命名规则,下列命名正确的是( )
| A. | 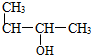 1-甲基-2-丙醇 | B. | 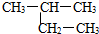 2-甲基丁烷 | C. |  1,2,3-甲基丙烷 | D. | 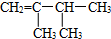 2,3-甲基-3-丁烯 |
7.下列指定反应的离子方程式正确的是( )
| A. | Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
 ,写出HFO的结构式H-O-F.
,写出HFO的结构式H-O-F.