题目内容
16.(I)、A、B、C、D、E、五种元素均是短周期元表.且原子序数依次增大.A的原子半径最小,B、E原子的最外层电子均均为其电子层数的2倍,D、E元素原子的最外层电子数相等,X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成.元表B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M 反应生成X、Y、Z.乙与M反应生成Y、Z、W,且X、Y、W均能与Z反应,反应条件均省略.回答下列有关问题:(l)X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中.待水不再上升时,试管内溶质的物质的量浓度是$\frac{1}{28}$mol/L(假设溶质不扩散)
(2)若将X、W、D2按4:4:3通入Z中充分反应.写出总的离子方程式4NO2+4SO2+3O2+6H2O═4NO3-+4SO42-+12H+
(3)G是一种既能与强酸又能与强碱反应的酸式盐,则G的化子式NH4HS,取0.2mol/L的NaOH溶液与
0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).此时测待溶液的pH=12.则此条件下G中阴离子的电离平衡常数Ka=4×10-12
(Ⅱ)(4)某温度时.向AgNO3溶液中加入K2CrO4溶液会生成Ag2CrO4沉淀,Ag2CrO4在
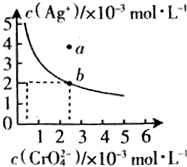 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.A.Ag2CrO4的溶度积常数(Ksp)为1×10-8
B.含有大量CrO42- 的溶液中一定不存在Ag+
C.a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D.0.02mol•L-1的AgNO3溶液与0.02mol•L-1的Na2CrO4溶液等体积混合会生成沉淀
(5)若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol•L-1,溶液的pH应调至5.
分析 (I).A、B、C、D、E五种元素均是短周期主族元素,且原子序数依次增大.B、E原子的最外层电子数均为其电子层数的2倍,分别处于第二、第三周期,则B为C元素、E为S元素;D、E元素原子的最外层电子数相等,二者同主族,则D为O元素;C的原子序数介于碳、氧之间,则C为N元素;A的原子半径最小,则A为H元素;
X、Y、Z、W、G、甲、乙七种物质均由上述元素中的两种或三种元素组成,元素B形成的单质M为碳,与甲、乙浓溶液均能反应(相对分子质量:甲<乙),可推知:甲为HNO3、乙为H2SO4,甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,则X为NO2,W为SO2,Y、Z分别为H2O、CO2中的一种,X、Y、W均能与Z反应,则:Y为CO2,Z为H2O.
(1)NO2和O2按4:1充满试管后将其倒立于水槽中,发生反应4NO2+O2+H2O=4HNO3,溶液体积等于混合气体的体积,令混合气体体积为5L,计算生成硝酸的物质的量,进而计算所得硝酸的浓度;
(2)若将NO2、SO2、O2按4:4:3通入H2O中充分反应,根据电子转移守恒可知,反应生成硝酸、硫酸;
(3)G是一种既能与强酸又能与强碱反应的酸式盐,G由上述元素中的两种或三种元素组成,则G为NH4HS,取0.2mol/L的NaOH溶液与0.1mol/L的NH4HS溶液等体积混合后,二者物质的量之比为2:1,加热至充分反应生成Na2S、氨气与水,待恢复至室温剩余溶液为Na2S溶液,溶液中S2-水解,溶液呈碱性,水的电离与产生氢氧根离子,故c(OH-)>c(HS-),溶液中氢离子浓度最小,溶液中氢氧根离子原因水的电离、S2-水解、HS-的水解,溶液中c(OH-)>c(HS-);
此时测得溶液的PH=12,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,由于S2-+H2O?OH-+HS-,溶液中氢氧根离子源于硫离子水解及水的电离,故溶液中c(HS-)=10-2mol/L-10-12mol/L≈10-2mol/L,溶液中c(S2-)=0.1mol/L×$\frac{1}{2}$-10-2mol/L=0.04molL,由HS-?S2-+H+,可知其电离常数Ka=$\frac{c({S}^{2-})×c({H}^{+})}{c(H{S}^{-})}$,代入数据计算;
(Ⅱ)(4)A.Ag2CrO4的溶度积常数Ksp=c2(Ag+)×c(CrO42-),结合b点离子浓度计算;
B.Ag2CrO4存在溶解平衡;
C.a点离子浓度积大于Ksp,为过饱和溶液,有晶体析出;
D.计算混合后未反应时c2(Ag+)×c(CrO42-),与Ksp相比较进行判断;
(5)根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)计算溶液中c(OH-),再根据Kw=c((H+)•c(OH-),计算溶液中c(H+),再根据pH=-lg(H+)计算.
解答 解:(I).A、B、C、D、E五种元素均是短周期主族元素,且原子序数依次增大.B、E原子的最外层电子数均为其电子层数的2倍,分别处于第二、第三周期,则B为C元素、E为S元素;D、E元素原子的最外层电子数相等,二者同主族,则D为O元素;C的原子序数介于碳、氧之间,则C为N元素;A的原子半径最小,则A为H元素;
X、Y、Z、W、G、甲、乙七种物质均由上述元素中的两种或三种元素组成,元素B形成的单质M为碳,与甲、乙浓溶液均能反应(相对分子质量:甲<乙),可推知:甲为HNO3、乙为H2SO4,甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,则X为NO2,W为SO2,Y、Z分别为H2O、CO2中的一种,X、Y、W均能与Z反应,则:Y为CO2,Z为H2O.
(1)(1)NO2和O2按4:1充满试管后将其倒立于水槽中,发生反应4NO2+O2+H2O=4HNO3,溶液体积等于混合气体的体积,令混合气体体积为5L,则硝酸的物质的量=$\frac{4L}{22.4L/mol}$=$\frac{1}{5.6}$mol,故所得溶液的物质的量浓度=$\frac{\frac{1}{5.6}mol}{5L}$=$\frac{1}{28}$mol/L,
故答案为:$\frac{1}{28}$mol/L;
(2)若将NO2、SO2、O2按4:4:3通入H2O中充分反应,根据电子转移守恒可知,反应生成硝酸、硫酸,反应总的离子方程式为:4NO2+4SO2+3O2+6H2O═4NO3-+4SO42-+12H+,
故答案为:4NO2+4SO2+3O2+6H2O═4NO3-+4SO42-+12H+;
(3)G是一种既能与强酸又能与强碱反应的酸式盐,G由上述元素中的两种或三种元素组成,则G为NH4HS;
取0.2mol/L的NaOH溶液与0.1mol/L的NH4HS溶液等体积混合后,二者物质的量之比为2:1,加热至充分反应生成Na2S、氨气与水,待恢复至室温剩余溶液为Na2S溶液,溶液中S2-水解,溶液呈碱性,水的电离与产生氢氧根离子,故c(OH-)>c(HS-),溶液中氢离子浓度最小,故溶液中c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
此时测得溶液的PH=12,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,由于S2-+H2O?OH-+HS-,溶液中氢氧根离子源于硫离子水解及水的电离,故溶液中c(HS-)=10-2mol/L-10-12mol/L≈10-2mol/L,溶液中c(S2-)=0.1mol/L×$\frac{1}{2}$-10-2mol/L=0.04molL,由HS-?S2-+H+,可知其电离常数Ka=$\frac{c({S}^{2-})×c({H}^{+})}{c(H{S}^{-})}$=$\frac{0.04×1{0}^{-12}}{1{0}^{-2}}$=4×10-12,
故答案为:NH4HS;c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);4×10-12;
(Ⅱ)(4)A.由b点离子浓度可知,Ag2CrO4的溶度积常数Ksp=c2(Ag+)×c(CrO42-)=(2×10-3)2×2.5×10-3=1×10-8,故A正确;Ksp
B.Ag2CrO4存在溶解平衡,Ag+和CrO42-同时存在,故B错误;
C.a点离子浓度积c2(Ag+)×c(CrO42-)>1×10-8,为过饱和溶液,有晶体析出,故C错误;
D.0.02mol•L-1的AgNO3溶液与0.02mol•L-1的Na2CrO4溶液等体积混合,混合后未反应时c2(Ag+)×c(CrO42-)=(0.01)2×0.01=1×10-6>1×10-8,有晶体析出,故D正确,
故选:AD;
(5)要使c(Cr3+)降至10-5mol•L-1,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=10-32,则溶液中c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{5}}}$mol/L=10-9mol/L,根据Kw=c((H+)•c(OH-)可知溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,此时溶液pH=-lg(H+)=5,故溶液的pH应调至5,
故答案为:5.
点评 本题属于拼合型题目,涉及元素化合物推断、溶度积的有关计算等,I中元素及物质的推断为解答本题的关键,需要学生熟练掌握元素化合物知识,(3)中计算为易错点,不能认为氢氧根与硫氢根离子浓度相等,注意忽略计算,难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 33种 | B. | 31种 | C. | 28种 | D. | 19种 |
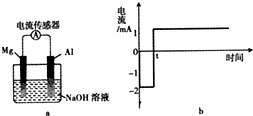 将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )
将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )| A. | 实验过程中,铝电极表面可能有气泡产生 | |
| B. | 0-t时刻,镁电极上发生反应:Mg-2e-+2OH-=Mg(OH)2 | |
| C. | t时刻时,铝和镁的金属活动性相同 | |
| D. | t时刻后,电池主要的总反应方程式:4Al+3O2+4OH-=4AlO2-+2H2O |
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H2O>溴苯> | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
| W | X | ||
| Y | Z |
| A. | W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料 | |
| B. | Z元素的最高价氧化物水化物的酸性强于Y | |
| C. | 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定 | |
| D. | 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性 |
 ,写出HFO的结构式H-O-F.
,写出HFO的结构式H-O-F.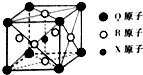 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.