题目内容
18.氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响.铵盐在工农业生产、生活中有着重大作用.完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
分析 (1)根据N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g)为放热反应,则升温平衡向吸热方向即逆反应方向移动,则温度越高K越小,据此判断;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:(1)因为N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g)为放热反应,则升温平衡向吸热方向即逆反应方向移动,则温度越高K越小,所以K1>K2,故答案为:>;
(2)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明各物质的浓度不再发生变化,故不能说明达到平衡状态,故a错误;
b.因为v(H2)逆=3v(N2)逆,又v(N2)正=3v(H2)逆,所以v(N2)正=9v(N2)逆,正逆反应速率相等,故不能说明达到平衡状态,故b错误;
c.因为反应前后气体体积发生变化,所以压强保持不变,则能说明达到平衡状态,故c正确;
d.密度=$\frac{总质量}{体积}$,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故d错误;
故选c.
点评 本题考查平衡常数随温度的变化以及化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征以及该反应为放热反应即可答题.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
8.下列关系正确的是( )
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H2O>溴苯> | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
9.根据有机化合物的命名规则,下列命名正确的是( )
| A. | 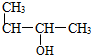 1-甲基-2-丙醇 | B. | 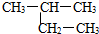 2-甲基丁烷 | C. |  1,2,3-甲基丙烷 | D. | 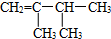 2,3-甲基-3-丁烯 |
13.天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11).该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如图所示(注意图中的反应式不完整).
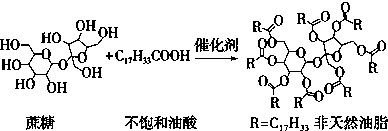
下列说法正确的是( )

下列说法正确的是( )
| A. | 蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质 | |
| B. | 该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应 | |
| C. | 非天然油脂为高分子化合物 | |
| D. | 该蔗糖酯在稀硫酸的作用下水解,最终可生成多种有机分子 |
3.下列各组离子在水溶液能大量共存的是( )
| A. | Cu2+、K+、OH-、SO42- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | NH4+、Al3+、AlO2-、H+ | D. | SO32-、Ba2+、H+、NO3- |
10.80℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=3的碳酸中:c(H+)=3.0mol•L-1 | |
| B. | 饱和乙酸钠溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH为2的盐酸中:c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=13的烧碱溶液中:c(OH-)=1.0×10-1mol•L-1 |
7.下列指定反应的离子方程式正确的是( )
| A. | Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
8.下列表示对于化学反应的离子方程式正确的是( )
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 误将洁厕灵与84消毒液混合:H++Cl-+HClO=Cl2↑+H2O | |
| C. | 酸性高锰酸钾和过氧化氢制取少量氧气:2MnO4-+12H++4H2O2═4Mn2++7O2↑+10H2O | |
| D. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O |