题目内容
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
分析 A、碳酸钠显示碱性,碳酸根离子存在水解平衡,据此确定离子浓度的大小关系;
B、根据溶液中的电荷守恒来回答判断;
C、根据物料守恒来判断;
D、根据质子守恒来判断.
解答 解:A、碳酸钠显示碱性,碳酸根离子存在水解平衡,定离子浓度的大小关系:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故A错误;
B、溶液中存在的电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B错误;
C、溶液中存在物料守恒c(Na+)=2{c(CO32-)+c(HCO3-)+c(H2CO3)},故C错误;
D、溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故选D.
点评 本题考查学生电解质溶液中各种守恒思想的应用知识,注离子浓度大小关系的比较方法是重点也是难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列说法正确的是( )
| A. | 任何状态下,1molCO2和18克水所含的分子数和原子数都相等 | |
| B. | 22.4L的任何气体的物质的量为1mol | |
| C. | 非标准状况下,1mol任何气体的体积必定不是22.4L | |
| D. | 标准状况下,1molSO3的体积是22.4L |
16.下列关于物质的性质和应用的说法均正确的是( )
| 选项 | 性质 | 应用 |
| A | 油脂在一定条件下能发生水解反应 | 油脂在碱性条件下水解制肥皂 |
| B | 硫酸铵等盐类 能使蛋白质变性 | 可用硫酸铵作杀菌消毒剂 |
| C | 糖类都能发生水解反应 | 可用淀粉、纤维素水解制葡萄糖 |
| D | 明矾溶于水可发生水解反应 | 明矾可用于自来水的净化、杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
20.物质的量浓度相同时,下列既能跟NaOH溶液反应、又能跟盐酸溶液反应的溶液中,pH最大的是( )
| A. | Na2CO3溶液 | B. | Na[Al(OH)4]溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
10.下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | Cl2+H2O?HC1+HC1O | D. | Na2CO3+BaC12=BaCO3↓+2NaC1 |
17.可以判断恒容密闭容器中分解反应NH2COONH4(s)?2NH3(g)+CO2(g)已达到化学平衡状态的是( )
| A. | 混合气体的平均分子质量不变 | B. | 密闭容器中总压强不变 | ||
| C. | 混合气体的密度不变 | D. | 密闭容器中CO2的体积分数不变 |
14.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
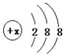 有几种元素的微粒电子层结构如图所示,其中:
有几种元素的微粒电子层结构如图所示,其中: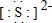 .
.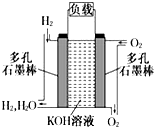 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: