题目内容
10.下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | Cl2+H2O?HC1+HC1O | D. | Na2CO3+BaC12=BaCO3↓+2NaC1 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,既有共价键和离子键断裂,又有共价键和离子键形成,说明发生化学反应,据此分析解答.
解答 解:A.该反应中有金属键的断裂,但没有离子键的断裂,故A错误;
B.该反应过氧化钠中有离子键和共价键的断裂,碳酸钠中有离子键和共价键的形成,故B正确;
C.该反应中没有离子键的断裂和形成,故C错误;
D.该反应中没有共价键的断裂和形成,故D错误;
故选B.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,知道哪些物质中含有离子键,题目难度不大.

练习册系列答案
相关题目
16.在一定条件下,既能发生酯化反应,又能发生消去反应的是( )
| A. | CH3CH2OH | B. | CH3OH | C. | CH3CHO | D. | CH3COOH |
1.元素A的单质及A与B形成的化合物能按如图所示的关系发生转化.则下列说法正确的是( )
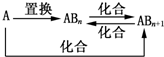

| A. | 图中物质间的转化都不是氧化还原反应 | |
| B. | 当n=1时,A可能是N2 | |
| C. | A一定是金属元素 | |
| D. | 当n=2时,A可能是Fe |
18.已知反应:
①101KPa时,2C(s)+O2(g)=2CO(g);△H=-221KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
下列结论正确的是( )
①101KPa时,2C(s)+O2(g)=2CO(g);△H=-221KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热等于110.5KJ/mol | |
| B. | 2C(s)+2O2(g)=2CO2(g);△H>-221 KJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 KJ |
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
15.一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g)?2C(g)达到平衡时,下列说法正确的是( )
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变 ⑦容器中C的体积分数不变.
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变 ⑦容器中C的体积分数不变.
| A. | ②④⑤⑦ | B. | ①③④⑥⑦ | C. | ①④⑥⑦ | D. | ①③④⑤ |
2.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |
19.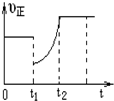 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |




 .
.