题目内容
16.下列关于物质的性质和应用的说法均正确的是( )| 选项 | 性质 | 应用 |
| A | 油脂在一定条件下能发生水解反应 | 油脂在碱性条件下水解制肥皂 |
| B | 硫酸铵等盐类 能使蛋白质变性 | 可用硫酸铵作杀菌消毒剂 |
| C | 糖类都能发生水解反应 | 可用淀粉、纤维素水解制葡萄糖 |
| D | 明矾溶于水可发生水解反应 | 明矾可用于自来水的净化、杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.油脂在碱性条件下的水解反应为皂化反应;
B.硫酸铵不是重金属盐,不能使蛋白质发生变性;
C.单糖不水解;
D.具有强氧化性的物质能够杀菌消毒.
解答 解:A.油脂在碱性条件下的水解生成高级脂肪酸钠,可用于制取肥皂,故A正确;
B.重金属盐类能使蛋白质凝结变性,失去原有的生理功能,所以误食重金属盐能使人中毒,硫酸铵不是重金属盐,不能使蛋白质发生变性,故B错误;
C.糖类中单糖不能发生水解反应,故C错误;
D.明矾中铝离子水解生成氢氧化铝胶体,胶体能净水,明矾没有强氧化性,所以不能杀菌消毒,故D错误.
故选A.
点评 本题考查较为综合,侧重于有机物的组成、性质和应用,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
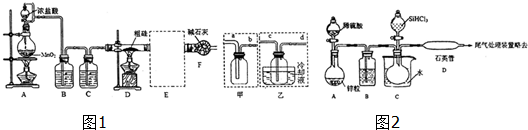
2. 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
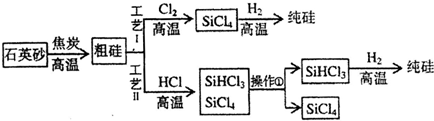
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
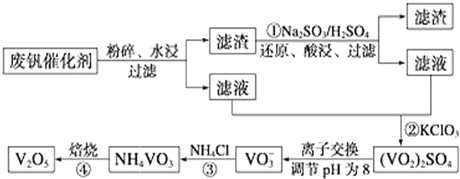
部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
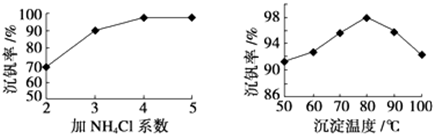
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.

(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
1.元素A的单质及A与B形成的化合物能按如图所示的关系发生转化.则下列说法正确的是( )
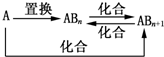

| A. | 图中物质间的转化都不是氧化还原反应 | |
| B. | 当n=1时,A可能是N2 | |
| C. | A一定是金属元素 | |
| D. | 当n=2时,A可能是Fe |
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
6.下列说法正确的是( )
| A. | 第二周期元素的第一电离能随原子序数递增依次增大 | |
| B. | CH2=CH2分子中共有四个σ键和一个π键 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | 电负性:S>P |
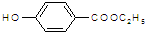
 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.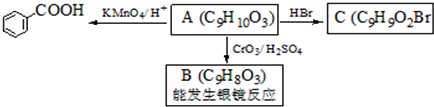
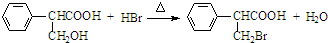 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).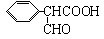 .
.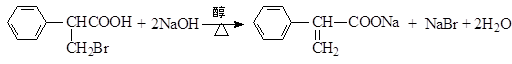 .
. )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).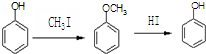

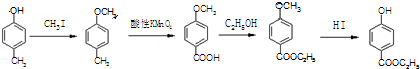
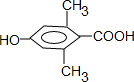 .
.