题目内容
11.下列说法正确的是( )| A. | 任何状态下,1molCO2和18克水所含的分子数和原子数都相等 | |
| B. | 22.4L的任何气体的物质的量为1mol | |
| C. | 非标准状况下,1mol任何气体的体积必定不是22.4L | |
| D. | 标准状况下,1molSO3的体积是22.4L |
分析 A、1molCO2中含3mol原子,根据水的质量求出水的物质的量,然后根据1mol水中含3mol原子来分析;
B、气体所处的状态不明确;
C、标准状况下,气体摩尔体积为22.4L/mol,当气体摩尔体积为22.4L/mol时,不一定是标况;
D、标况下,三氧化硫为固态.
解答 解:A、任何状态下,1molCO2中均含NA个分子,且1mol二氧化碳中含含3mol原子,即3NA个原子;18g水的物质的量为1mol,故为NA个分子,而1mol水中含3mol原子,即3NA个,故A正确;
B、气体所处的状态不明确,不一定是标况,故气体摩尔体积不一定是22.4L/mol,则22.4L气体的物质的量不一定是1mol,故B错误;
C、标准状况下,气体摩尔体积为22.4L/mol,当气体摩尔体积为22.4L/mol时,不一定是标况,故在非标况下,气体摩尔体积也可能是22.4L/mol,即1mol气体的体积可能是22.4L,故C错误;
D、标况下,三氧化硫为固态,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选A.
点评 本题考查了气体摩尔体积的数值和有关计算,应注意的是标准状况下,气体摩尔体积为22.4L/mol,当气体摩尔体积为22.4L/mol时,不一定是标况.

练习册系列答案
相关题目
2. 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
19.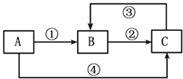 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )| A. | ①中所加试剂可能是氯气 | |
| B. | ③中需要加具有氧化性的试剂 | |
| C. | A与稀硝酸反应一定能实现元素M在①中发生的价态变化 | |
| D. | 元素M在②中发生的价态变化也能通过加碘化钾溶液实现 |
6.某原电池总反应离子方程式为.2Fe3++Fe?3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |
16.在一定条件下,既能发生酯化反应,又能发生消去反应的是( )
| A. | CH3CH2OH | B. | CH3OH | C. | CH3CHO | D. | CH3COOH |
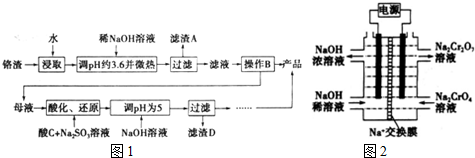
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
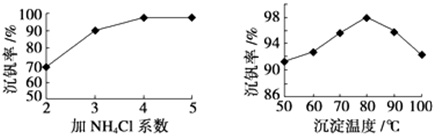
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.

(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |