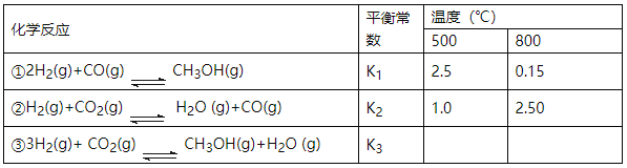
题目内容
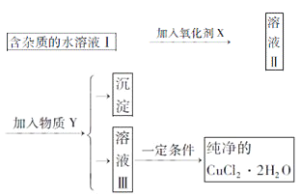
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。
【答案】C CuO或Cu(OH)2 不能 加碱的同时Cu2+也会沉淀下来 Fe3++3H2O ![]() Fe(OH)3+3H+ CuO+2H+= Cu2++H2O 将Fe2+氧化为Fe3+再除去 不能 应在氯化氢气氛中浓缩后冷却结晶
Fe(OH)3+3H+ CuO+2H+= Cu2++H2O 将Fe2+氧化为Fe3+再除去 不能 应在氯化氢气氛中浓缩后冷却结晶
【解析】
本实验的目的是用恰当方法除去CuCl22H2O中的FeCl2,结合已学知识,可想到用沉淀法除去Fe2+,但由题目叙述可知,Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开.而题目告知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去;为避免引入新的杂质,结合H2O2还原为H2O的特点,过量时也可用加热的方法使其分解而除去,氧化剂应选用H2O2;为了调节溶液的酸度,使pH在3.7的范围,可用CuO降低溶液中H+浓度,而CuO与酸反应后生成Cu2+,也不引入新的杂质,过量的CuO用过滤的方法与生成的Fe(OH)3沉淀一并除去.CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl气氛中采用低温减压蒸发结晶的方法,以得到CuCl22H2O的晶体。
(1)进行物质除杂时,所选用的试剂不能引入新的杂质;
A使用重铬酸钾做氧化剂能引入杂质离子,故A错误;
B使用次氯酸钠做氧化剂能引入杂质离子,故B错误;
C.使用双氧水做氧化剂,生成的是水,过量能加热除去,使用氧化铜与酸反应生成的是铜离子,不引入新的杂质,故C正确,
D.使用高锰酸钾做氧化剂能引入杂质离子,故D错误;
答案:C
(2)物质Y是用来调节pH为3.7,使得铁离子完全沉淀,因为不能引入新的杂质,所以用CuO或Cu(OH)2;
答案:CuO或Cu(OH)2
(3)采用加碱法除去氯化亚铁,则铜离子也会沉淀,故不能使用加碱法除去氯化亚铁;
答案: 不能 加碱的同时Cu2+也会沉淀下来
(5)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去;
答案:将Fe2+氧化为Fe3+再除去
(6)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl气氛中采用低温减压蒸发结晶的方法,以得到CuCl22H2O的晶体;
答案:不能 应在氯化氢气氛中浓缩后冷却结晶。

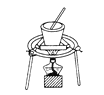
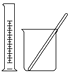
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D