题目内容
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为__,当6.4g铜溶解时转移电子物质的量为___mol;
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式____;
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓ +I3- ②I3-+2S2O32-= S4O62-+ 3I-
反应①中的还原剂为____,现取10.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.100 mol/L的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol/L。
【答案】Cu+H2O2+H2SO4=CuSO4+2H2O 0.2 2Fe3++Cu=Cu2++2Fe2+ I- 0.25
【解析】
(1)利用H2O2的氧化性,将Cu氧化成CuSO4,本身被还原成H2O,,该反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O;该反应中Cu元素的化合价由0价→+2价,因此6.4gCu溶解时,转移电子物质的量为![]() =0.2mol;
=0.2mol;
答案为Cu+H2O2+H2SO4=CuSO4+2H2O;0.2mol;
(2)刻蚀印刷电路板中的铜箔,利用Fe3+的强氧化性,该过程中发生离子方程式为Cu+2Fe3+=2Fe2++Cu2+;
答案为Cu+2Fe3+=2Fe2++Cu2+;
(3)还原剂是化合价升高的物质,根据①反应,I的化合价升高,即还原剂为I-;根据①②,建立2Cu2+~I3-~2S2O32-,n(Cu2+)=n(S2O32-)=25.00×10-3L×0.100mol·L-1=2.5×10-3mol,则c(Cu2+)=![]() =0.25mol·L-1;
=0.25mol·L-1;
答案为0.25。

【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
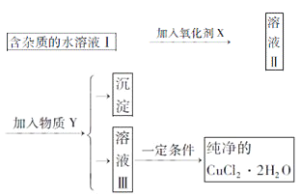
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。