题目内容
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
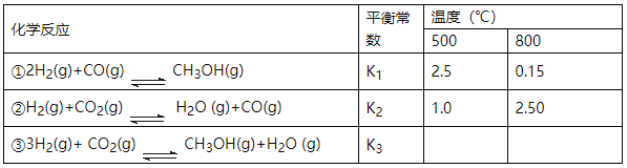
请回答下列问题:
(1)反应②是__________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________(用K1、K2表示);根据反应③判断△S__________0(填“>”、“=”或“<”),在____________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______________(填写字母序号)。
a.缩小反应容器的容积
b.扩大反应容器的容积
c.升高温度
d.使用合适的催化剂
e.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol·L-1、0.8mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v正__________v逆(填“>”、“=”或“<”)。
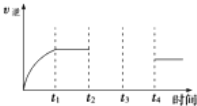
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线______。
【答案】吸热 K1·K2 < 较低 bc > 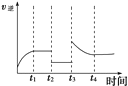
【解析】
(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应;
(2)根据盖斯定律计算平衡常数,在结合合温度变化分析平衡常数的变化;
(3)a缩小反应容器的容积,缩小反应容器的容积,压强增大,平衡向正向移动,故a错误;
b扩大反应容器的容积,扩大反应容器的容积,压强减小,平衡逆向移动,故b正确;
c由于K3=K1×K2,由表中数据可知,升高温度平衡常数减小,平衡逆向移动,故c正确;
d使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故d错误;
f从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故f错误;
(4)根据浓度商与平衡常数的比较判断;
(5)反应②CO2(g)+H2(g)CO(g)+H2O(g)是气体体积不变的吸热反应,反应的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,逆反应速率增大,t1时平衡,t2时降压,逆反应速率减小,平衡不变,t3时增加CO浓度,此时刻逆反应速率增大,随反应进行减小,达到平衡状态大于t2-t3平衡状态的逆反应速率,t4时又达到平衡,依据反应速率影响分析绘制出去下变化。
(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应,
故答案为:吸热;
(2)反应①+②可得反应③,则平衡常数K3=K1×K2,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.50×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,根据△H-T△S<0,确定反应在低温下能自发进行;
答案:K1×K2;<;较低;
(3)a缩小反应容器的容积,缩小反应容器的容积,压强增大,平衡向正向移动,故a错误;
b扩大反应容器的容积,扩大反应容器的容积,压强减小,平衡逆向移动,故b正确;
c由于K3=K1×K2,由表中数据可知,升高温度平衡常数减小,平衡逆向移动,故c正确;
d使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故d错误;
f从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故f错误;
答案:bc
(4)500℃时K3=K1×K2=2.5,浓度商Qc=![]() =0.088<K=2.5,反应向逆反应进行,故v(正)>v(逆);
=0.088<K=2.5,反应向逆反应进行,故v(正)>v(逆);
答案:>
(5)反应②CO2(g)+H2(g)CO(g)+H2O(g)是气体体积不变的吸热反应,反应的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,逆反应速率增大,t1时平衡,t2时降压,逆反应速率减小,平衡不变,t3时增加CO浓度,此时刻逆反应速率增大,随反应进行减小,达到平衡状态大于t2-t3平衡状态的逆反应速率,t4时又达到平衡,依据反应速率影响分析绘制出去下变化;画出t2至t4的曲线为如图所示:
答案:

 三新快车金牌周周练系列答案
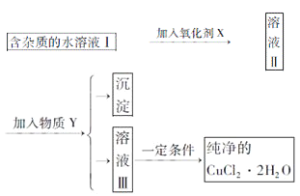
三新快车金牌周周练系列答案【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。