题目内容
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A. ①⑥B. ①⑥⑦C. ②③④⑥D. ①②⑥⑦
【答案】A
【解析】
①升高温度,平衡向吸热即逆反应向移动;
②向溶液中加入少量碳酸钠粉末,反应产生碳酸钙沉淀;
③除去氯化钠溶液中混有的少量Ca2+,根据平衡移动原理分析;
④恒温下,向饱和溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍然为氢氧化钙饱和溶液;
⑤Ca(OH)2的溶解度随温度的升高而降低;
⑥向溶液中加入Na2CO3 溶液,氢氧化钙转化成碳酸钙沉淀,固体质量增加;
⑦向溶液中加入少量NaOH固体,OH-浓度增大,平衡向逆方向移动。
①Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,该反应为放热反应,升高温度平衡向吸热的逆反应向移动,①正确;
Ca2+(aq)+2OH-(aq) ΔH<0,该反应为放热反应,升高温度平衡向吸热的逆反应向移动,①正确;
②向溶液中加入少量碳酸钠粉末,CO32-与Ca2+结合生成CaCO3沉淀,导致溶液中c(Ca2+)减小,②错误;
③若要除去氯化钠溶液中混有的少量Ca2+,加入适量的NaOH溶液,形成氢氧化钙,并不能除去钙离子,反而会引入氢氧化钙杂质,③错误;
④恒温下,向饱和溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍为该温度下的饱和溶液,Ca(OH)2的浓度不变,溶液的pH不变,④错误;
⑤由于Ca(OH)2的溶解度随温度的升高而降低,所以给溶液加热,Ca(OH)2的溶解度降低,氢氧根离子的浓度减小,则溶液pH减小,⑤错误;
⑥向溶液中加入Na2CO3 溶液,发生反应Ca2++CO32-=CaCO3↓,导致固体质量增加,⑥正确;
⑦向溶液中加入少量NaOH固体,NaOH溶解电离产生OH-,使溶液中OH-浓度增大,根据平衡移动原理,增大OH-的浓度,Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)的平衡向逆方向移动,最终达到平衡时,Ca(OH)2固体的质量会增多,⑦错误;
Ca2+(aq)+2OH-(aq)的平衡向逆方向移动,最终达到平衡时,Ca(OH)2固体的质量会增多,⑦错误;
则合理说法是①⑥,故正确选项是A。

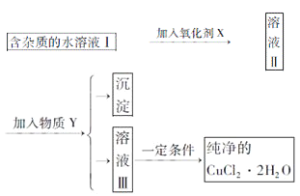
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。