题目内容
【题目】现有下列9种物质:①氯气;②二氧化硫;③稀硫酸;④铁;⑤BaCl2固体;⑥氢氧化钾;⑦KNO3溶液;⑧酒精(C2H5OH);⑨氧化钙,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:属于酸性氧化物的有_____________,属于碱性氧化物的有____________,属于电解质的是______,属于非电解质的是_______。(用序号填空)
(2)写出NaHCO3电离方程式:______
(3)用双线桥表示Cl2与二氧化硫的反应________
【答案】② ⑨ ⑤⑥⑨ ②⑧ NaHCO3 =Na++HCO3- 
【解析】
①氯气为单质,既不是电解质,也不是非电解质;
②二氧化硫为化合物,酸性氧化物,能与水反应,其液态不导电,为非电解质;
③稀硫酸为混合物,既不是电解质,也不是非电解质;
④铁为单质,既不是电解质,也不是非电解质;
⑤BaCl2固体为化合物,其水溶液能导电,为电解质;
⑥氢氧化钾固体为化合物,其水溶液能导电,为电解质;
⑦KNO3溶液为混合物,既不是电解质,也不是非电解质;
⑧酒精(C2H5OH) 为化合物,其水溶液不能导电,是非电解质;
⑨氧化钙为碱性氧化物,能与水反应,其液态能导电,为电解质;
(1)根据分析,属于酸性氧化物的有②;属于碱性氧化物的有⑨;属于电解质的是⑤⑥⑨;属于非电解质的是②⑧;
(2)NaHCO3为强电解质,水溶液在完全电离为钠离子和碳酸氢根离子,电离方程式为强电解质NaHCO3 =Na++HCO3-;
(3)Cl2+SO2+2H2O═2HCl+H2SO4中,Cl元素的化合价由0价变为-1价,S元素的化合价由+4价变为+6价,该反应转移2e-,则双线桥法表示下列反应中电子转移的方向和数目为 。
。

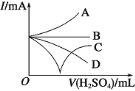
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
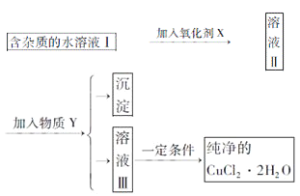
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。