题目内容
3.使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O,如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果.下列说法不正确的是( )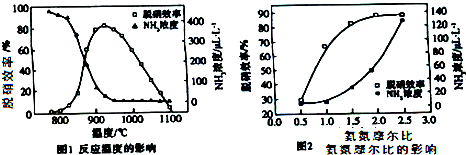
| A. | 从图1判断,该反应的正反应方向是放热反应 | |
| B. | 从图2判断,减少氨气的浓度有助于提高NO的转化率 | |
| C. | 从图1判断,脱硝的最佳温度约为925℃ | |
| D. | 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |
分析 由图1可知,氨气的浓度越大,脱硝效率越高,升高温度,脱硝效率先增大后减小,同时氨气的浓度越小,应综合考虑反应的平衡移动问题;由图2可知,增大氨气的浓度,脱硝效率增大,以此解答该题.
解答 解:A.如仅考虑脱硝效率越高,升高温度,脱硝效率先增大后减小,说明升高温度平衡向逆向移动,正反应放热,但如从氨气的浓度变化的角度考虑,升高温度氨气的浓度降低,说明反应向正向移动,则正反应为吸热反应,二者矛盾,不能说明正反应为放热反应,故A错误;
B.从图2判断,增大氨气的浓度有助于提高NO的转化率,故B错误;
C.从图1判断,脱硝的最佳温度约为925℃,此时脱硝效率最大,故C正确;
D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.0,2.0~2.5时脱硝效率变化不大,故D错误.
故选ABD.
点评 本题考查化学平衡的影响,侧重于化学与工业生产的关系,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度中等,注意把握图象的曲线变化特点.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
13.在下列物质中:①Al ②NaHCO3 ③Al2O3 ④(NH4)2S ⑤SiO2 ⑥Al(OH)3⑦AgNO3 ⑧Na2CO3既能和盐酸反应,又能后NaOH溶液反应的是( )
| A. | ①②③⑥ | B. | ①③④⑤⑧ | C. | ①②③④⑥⑦ | D. | 全部 |
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
| A. | X、Z、W位于同周期,Y与V位于同周期 | |
| B. | Y3+与V2-的核外电子数相等 | |
| C. | Y与W形成的化合物具有两性 | |
| D. | Z的氢化物可与V的最高价氧化物的水溶液反应生成盐 |
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
8.下列图示与叙述正确的是( )
| A. | 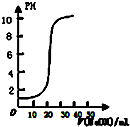 表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 | |
| B. | 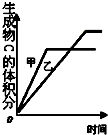 表示压强对可逆反应2A (g)+B (g)?3C (g)+D (s)的影响且甲的比乙的压强大 | |
| C. | 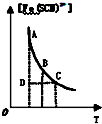 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 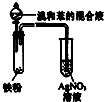 所示装置可证明溴与苯发生取代反应 |
15.下列除去杂质(括号内为杂质)的方法正确的是( )
①乙烷(乙烯):光照条件下通入Cl2,气液分离
②乙炔(硫化氢):酸性高锰酸钾溶液,洗气
③苯(苯酚):用浓溴水洗涤,分液
④乙醇(乙酸):加足量生石灰,蒸馏.
①乙烷(乙烯):光照条件下通入Cl2,气液分离
②乙炔(硫化氢):酸性高锰酸钾溶液,洗气
③苯(苯酚):用浓溴水洗涤,分液
④乙醇(乙酸):加足量生石灰,蒸馏.
| A. | 都不正确 | B. | ②③ | C. | ④ | D. | ③④ |
13.控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )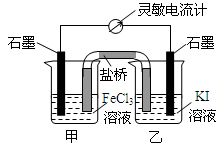

| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
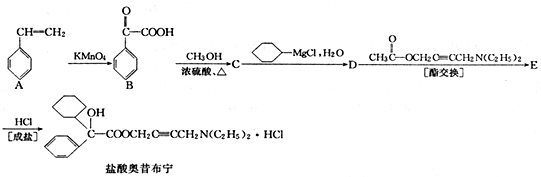
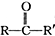 +
+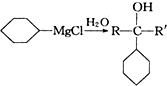 请回答下列问题
请回答下列问题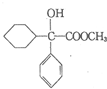 .
.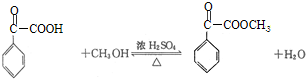 ,属取代反应.
,属取代反应.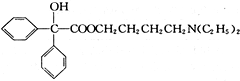 互为同分异构体
互为同分异构体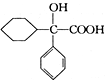 可发生缩聚反应.
可发生缩聚反应. ;
;