题目内容
13.在下列物质中:①Al ②NaHCO3 ③Al2O3 ④(NH4)2S ⑤SiO2 ⑥Al(OH)3⑦AgNO3 ⑧Na2CO3既能和盐酸反应,又能后NaOH溶液反应的是( )| A. | ①②③⑥ | B. | ①③④⑤⑧ | C. | ①②③④⑥⑦ | D. | 全部 |
分析 常见既能与酸反应又能与碱反应的物质主要有:两性物质:Al2O3、Al(OH)3、氨基酸、蛋白质等;多元弱酸的酸式盐:NaHCO3;弱酸的铵盐及其酸式盐:(NH4)2CO3、NH4HCO3、CH3COONH4等;某些金属:Zn、Al等;某些盐类物质既与酸反应,又与碱反应,某些酸性氧化物:SiO2据此解答.
解答 解:①Al与盐酸反应生成氯化铝和氢气,与氢氧化钠反应生成偏铝酸钠和氢气,故选;
②NaHCO3为多元弱酸的酸式盐,既能与盐酸又能与氢氧化钠反应,故选;
③Al2O3 两性物质,既能与盐酸又能与氢氧化钠反应,故选;
④(NH4)2S 为弱酸的铵盐,既能与盐酸又能与氢氧化钠反应,故选;
⑤SiO2 为酸性氧化物,能够与氢氟酸反应生成四氟化硅,但是不能与盐酸反应,能与氢氧化钠反应生成硅酸钠,故不选;
⑥Al(OH)3两性物质,既能与盐酸又能与氢氧化钠反应,故选;
⑦AgNO3 与盐酸反应生成氯化银沉淀,与氢氧化钠反应生成氢氧化银沉淀,氢氧化银不稳定分解生成氧化银,故选;
⑧Na2CO3能和盐酸反应,与氢氧化钠不反应,故不选;
故选:C.
点评 本题考查了元素化合物的性质,熟悉物质的性质尤其是两性物质是解题关键,注意对常见既能与酸反应又能与碱反应的物质的积累.

练习册系列答案
相关题目
3.下列分子中存在π键的是( )
| A. | H2O2 | B. | CHCl3 | C. | HBr | D. | HCN |
1.下列实验不能作为判断依据的是( )
| A. | Na和Mg分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 硅酸钠溶液通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| C. | F2与Cl2分别于足量的H2反应,判断氟和氯的非金属性强弱 | |
| D. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
5.甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流.关于此燃料电池的下列叙述正确的是( )
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为:202+8e-+4H20=80H- | |
| C. | 若甲烷通人量为1.12L(标准状况)且反应完全,则电池中有0.1mol02被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+202+4e-=C02+2H20 |
2.以乙醇为主要原料制乙二醛时,经过的反应为( )
| A. | 取代-消去-加成-氧化 | B. | 消去-加成-取代-氧化 | ||
| C. | 消去-取代-加成-氧化 | D. | 取代-加成-氧化-消去 |
3.使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O,如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果.下列说法不正确的是( )
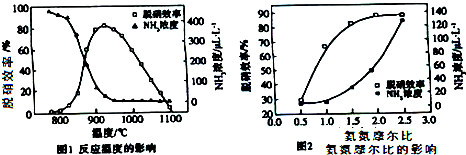

| A. | 从图1判断,该反应的正反应方向是放热反应 | |
| B. | 从图2判断,减少氨气的浓度有助于提高NO的转化率 | |
| C. | 从图1判断,脱硝的最佳温度约为925℃ | |
| D. | 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |
 由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題:
由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題: ,属于共价(“离子”或“共价”)化合物.
,属于共价(“离子”或“共价”)化合物.